
题目列表(包括答案和解析)
14.(17分)(2010·上海高考)工业生产纯碱的工艺流程示意图如下:
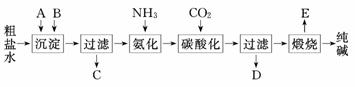
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式.
A.________,B.________.
(2)实验室提纯粗盐的实验操作依次为:
取样、________、沉淀、________、________、冷却结晶、________、烘干.
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是________________.碳酸化时没有析出碳酸钠晶体,其原因是________________________.
(4)碳酸化后过滤、滤液D最主要的成分是________________(填写化学式),检验这一成分的阴离子的具体方法是:________________________________.
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨.加石灰水后所发生的反应的离子方式程为:______________________________________________________,滤液D加石灰水前先要加热,原因是________________.
(6)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:________________________.
解析:(1)粗盐中含Ca2+、Mg2+,加入石灰乳或CaO可除去Mg2+,再加入Na2CO3除去Ca2+,因此A为Ca(OH)2或CaO,B为Na2CO3.
(3)碳酸化即向氨的饱和NaCl溶液中通入过量CO2,可析出NaHCO3晶体,反应中由于Na2CO3的溶解度大于NaHCO3的溶解度,因此不会析出Na2CO3晶体.
(4)过滤除去NaHCO3,滤液D的主要成分为NH4Cl,要检验Cl-应选用AgNO3溶液和稀硝酸.
(5)NH4Cl溶液与石灰水的反应为NH+OH-NH3↑+H2O.
(6)设加热前固体质量为m1,加热后剩余固体质量为m2,样品中NaHCO3质量为m.
2NaHCO3Na2CO3+H2O+CO2↑ Δm
168 106 62
m m1-m2
则m=(m1-m2)
w(NaHCO3)==.
答案:(1)Ca(OH)2或CaO Na2CO3 (2)溶解 过滤 蒸发 过滤
(3)有晶体析出(或出现浑浊) 碳酸钠溶解度比碳酸氢钠大
(4)NH4Cl 取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子
(5)NH+OH-―→NH3↑+H2O 防止加石灰水时产生碳酸钙沉淀
(6)wNaHCO3=(加热前的质量为m1,加热后为m2 )

13.(12分)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO、NO的相互分离.相应的实验过程可用下图表示:
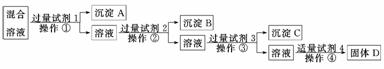
(1)写出上述实验过程中所用试剂的名称:
试剂1____________________________________________________________________,
试剂2_____________________________________________________________________.
(2)恰当地控制试剂4的加入量的方法是____________________________.
(3)加入过量试剂3的目的是__________________________________________________.
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是____________________________(填操作名称).
(5)写出加入试剂4后发生反应的离子方程式_________________________________.
(6)要检验原混合溶液中的Cl-,应该如何操作___________________________________
________________________________________________________________________.
解析:这是一道物质的分离题,解题的关键是确定所加的试剂及加入试剂的顺序.沉淀Cl-应加入AgNO3,沉淀SO应加入BaCl2或Ba(NO3)2溶液,因为SO也能和Ag+反应,所以要在沉淀SO后加入AgNO3.为了除去过量的Ag+和Ba2+,应加入过量的Na2CO3溶液,最后加入硝酸,调节溶液的pH=7.
答案:(1)氯化钡溶液或硝酸钡溶液 硝酸银溶液
(2)测定溶液的pH
(3)除去溶液中过量的Ba2+、Ag+
(4)过滤 蒸发、冷却结晶、过滤
(5)CO+2H+===CO2↑+H2O
(6)取原溶液少量于试管中,先加入足量Ba(NO3)2溶液沉淀SO,过滤后向滤液中加AgNO3溶液检验Cl-
12.(10分)(2010·潍坊模拟)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下实验:
黑色固体水溶解―→过滤―→固体灼烧
① ② ③
(1)上述三步操作中都用到的一种玻璃仪器是______________________________.
(2)将灼烧后的固体移入试管,滴加双氧水,能迅速产生一种使余烬的木条复燃的气体,由此推断黑色固体中含有MnO2,它在该反应中的作用为____________,写出该反应的化学方程式________________________________.MnO2有一定的氧化性,请写出一个MnO2作氧化剂的反应的化学方程式__________________________________________.
(3)验证步骤②的滤液中含有NH,下面是某一实验方案记录的片断.请填写下列空白:
实验过程:_________________________________________________________________.
实验现象:有刺激性气味的气体产生.
写出该实验中反应的离子方程式_____________________________________________.
解析: (1)①中溶解需用玻璃棒搅拌,②中过滤需用玻璃棒引流,③中灼烧需用玻璃棒搅拌.
(2)NH4Cl、ZnCl2易溶于水,因此溶解、过滤后得到的固体为MnO2,MnO2能够催化分解双氧水,化学方程式为:2H2O2MnO22H2O+O2↑.MnO2具有氧化性,能够氧化浓盐酸制取氯气,化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.
(3)检验滤液中含有NH,可以加入浓NaOH溶液并加热,发生反应:NH+OH-NH3↑+H2O,产生有刺激性气味的NH3.
答案:(1)玻璃棒
(2)催化剂 2H2O2MnO22H2O+O2↑
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3)取②的滤液适量于试管中,加入浓NaOH溶液,加热
NH+OH-NH3↑+H2O
11.(11分)如图表示从固体混合物中分离X的两种方案,请回答有关问题.
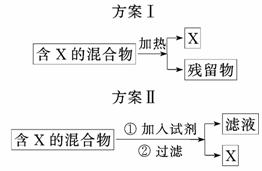
(1)选用方案Ⅰ时,X应该具有的性质是______________________,残留物应该具有的性质是______________________________;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是______________,有关反应的化学方程式为________________________________________;
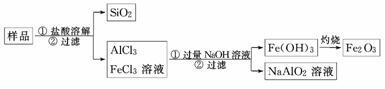
(3)为提纯某Fe2O3样品(主要杂质有SiO2、Al2O3),参照方案Ⅰ和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作).
解析:(1)用加热法分离X的混合物,X应具有的性质是易挥发(或易升华)但不易分解,而残留物沸点高,对热较稳定.
(2)方案Ⅱ中,加入HNO3,可将Cu、Ag溶解,而Au不溶.
(3)利用氧化铁是碱性氧化物,二氧化硅是酸性氧化物,而氧化铝是两性氧化物,则有
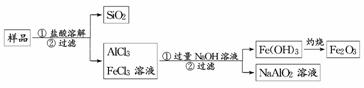
或者
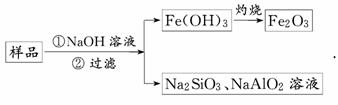
答案:(1)有挥发性(或易升华) 受热不挥发,且具有较高的热稳定性
(2)HNO3
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O
(或Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
Ag+2HNO3(浓)===AgNO3+NO2↑+H2O)
(3)
10.某实验探究小组为分离CO和CO2,设计了下图所示装置,其中叙述正确的是( )
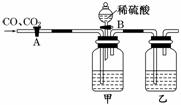
A.甲瓶中所盛的溶液是澄清石灰水,乙瓶中所盛的溶液是浓硫酸
B.甲瓶中所盛的溶液是饱和碳酸钠溶液,乙瓶中所盛的溶液是浓硫酸
C.活塞A开启,B关闭,可以分离得到干燥的CO;活塞B开启,A关闭,可以得到干燥的CO2
D.实验室中经过这种分离可以分别得到纯净的CO和CO2
解析:甲瓶中所盛的溶液应该是NaOH溶液或KOH溶液,A、B错误;实验起初装置中的空气没有被提前排出,所以分离得到的CO气体中会混有空气;当分离CO2气体时,装置中CO的气体又会混入到CO2气体中,D错误.
答案:C
9.某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如下表所示:
|
检测序号 |
溶液中检测出的离子组合 |
|
第一次 |
KCl、K2SO4、Na2CO3、NaCl |
|
第二次 |
KCl、AlCl3、Na2SO4、K2CO3 |
|
第三次 |
Na2SO4、KCl、K2CO3、NaCl |
则下列说法合理的是( )
A.三次检测结果都正确
B.该溶液中的阳离子无法判断
C.为了检验SO,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
D.为了确定是否存在CO,可以向其中滴加CaCl2溶液,观察是否有沉淀现象
解析:由于第二组中的AlCl3与K2CO3发生水解相互促进的反应,故不能共存,A错误;阳离子可以通过焰色反应确定,B错误;加入CaCl2溶液时,CaSO4也可能出现沉淀,无法确定一定存在CO,D错误.
答案:C
8.下面是四位同学为验证某无色气体为SO2而进行的实验设计,其中能够充分说明该气体是SO2的是( )
①甲同学将气体通入酸性KMnO4溶液中,溶液褪色,再滴入BaCl2溶液,出现白色沉淀;②乙同学用湿润的蓝色石蕊试纸检验该气体,试纸变红;③丙同学将气体通入品红溶液,溶液褪色,加热后又恢复红色;④丁同学将气体通入溴水,溴水褪色,再滴加酸化的氯化钡溶液有白色沉淀生成.
A.①②③④ B.①③④
C.③④ D.②③④
解析:甲、丁同学的实验设计中,SO2被氧化为SO,然后生成白色沉淀BaSO4;所有的酸性气体都能使湿润的蓝色石蕊试纸变红;SO2使品红褪色,生成的是不稳定的无色物质,加热时分解,SO2逸出,品红恢复红色.
答案:B
7.(2010·南京模拟)下列实验能达到预期目的的是( )
①用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子;②用溴水检验汽油中是否含有不饱和脂肪烃;③用乙醇从碘水中萃取碘;④用盐析方法分离提纯蛋白质;⑤用加热方法提纯含有少量碳酸氢钠的碳酸钠固体;⑥用氨水清洗试管壁附着的银镜
A.②④⑤ B.①③⑥
C.①②④⑤ D.②③④⑤⑥
解析:①由于鉴别时要加入酸,此时NO具有强氧化性,会将SO氧化为SO,故不正确;②若汽油中含有不饱和脂肪烃,则溴水褪色,正确;③乙醇和水互溶,故不正确;④盐析是物理变化,不会破坏蛋白质,正确;⑤碳酸氢钠不稳定,加热会分解,正确;⑥银不溶于氨水,不能用氨水清洗,应该用稀硝酸清洗.
答案:A
6.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
|
选项 |
被提纯的物质(杂质) |
除杂试剂 |
分离方法 |
|
A |
NH3(H2O) |
浓硫酸 |
洗气 |
|
B |
乙酸乙酯(乙酸) |
饱和碳酸钠溶液 |
分液 |
|
C |
KCl固体(I2) |
KOH溶液 |
加热 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
解析:NH3不能用浓硫酸干燥;氯化钾是离子化合物,熔点较高,碘单质受热易升华,应用加热法分离出KCl固体;苯中的少量苯酚与浓溴水反应生成的沉淀会溶于苯中.
答案:B
5.NaCl固体中混有下列杂质时,可以利用加热的方法进行提纯的是( )
A.KClO3 B.K2SO4
C.NH4Cl D.NaHCO3
解析:KClO3加热分解时会产生KCl,引入新的杂质;K2SO4受热不分解;NaHCO3受热分解产生Na2CO3,引入新的杂质.NH4Cl受热分解产生HCl和NH3,可以得到纯净的NaCl.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com