
题目列表(包括答案和解析)
12.(2010·湖北省八校联考)北京大学教授、著名的化学家和教育家徐光宪教授,是我国理论化学和稀土化学的奠基人之一,2008年获得“国家最高科学技术奖”,以表彰他在稀土理论方面作出的贡献,稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应并产生气体。已知:铈常见的化合价为+3价和+4价,且Ce4++Fe2+===Ce3++Fe3+。下列说法正确的是( )
A.用Pt作阴极,Fe作阳极,电解熔融CeO2,可在阳极获得铈
B.将少量的碘化亚铁溶液滴加到Ce(SO4)2溶液中,其离子方程式为:Ce4++Fe2+===Ce3++Fe3+
C.金属铈着火,可采用普通的泡沫灭火器灭火
D.金属铈可浸于煤油中保存,储存在阴凉、通风的地方,要远离火种和热源
解析:选项A,Fe为阳极为非惰性电极,电解时Fe溶解,在阳极得不到Ce。选项B,由于I-的还原性大于Fe2+,所以加入少量Ce(SO4)2溶液时,优先氧化I-而不是Fe2+。选项C,Ce能与H2O发生反应,不能用泡沫灭火剂灭火。选项D,根据信息和Na的性质推知其保存方法正确。
答案:D
11.某离子晶体R的晶体结构最小的重复单元如图所示,其中A为阴离子,B为阳离子,位于顶点和面心,有关叙述正确的是( )
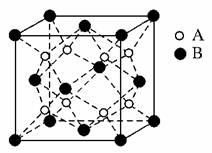
A.R的化学式为AB2
B.晶体R的熔点一定比金属晶体的熔点高
C.晶体R中,与B紧邻的A构成正八面体
D.R的电子式可能为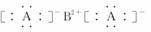
解析:晶体R的最小结构单元中,含A 8个,含B 8×1/8+6×1/2=4个,其化学式为BA2;金属晶体的熔点有低有高,因而无法比较;晶体R中,与B紧邻的A有8个,构成正方体。
答案:D
10.(2010·黄冈市质检)德国科学家格哈德·埃特尔研究的内容能帮助我们理解铁会生锈、燃料电池如何工作、催化剂如何工作而获得2007年诺贝尔化学奖。下列相关说法正确的是( )
A.含碳的生铁在发生电化学腐蚀的时候铁一般作正极
B.C2H6、O2、KOH构成的燃料电池放电一段时间后,负极周围的pH升高
C.CO、O2、KOH构成的燃料电池的负极反应式为:CO-2e-+4OH-===CO+2H2O
D.SO2被氧化为SO3时需使用V2O5作催化剂,这样可以提高SO2的转化率
解析:A项中生铁发生电化学腐蚀时,铁作负极;B项中乙烷、氧气和KOH燃料电池,在负极乙烷失电子生成的CO2要消耗OH-,使溶液的pH减小;D项中催化剂不能使平衡发生移动,不影响SO2的转化率。
答案:C
8.(2010·北京市西城区抽样)下列叙述中,正确的是( )
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
解析:船舶的外壳装上铜块形成原电池,铁作为负极而被腐蚀,A错;FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧分别得到Fe2O3、Fe2(SO4)3,C错;用惰性电极电解MgCl2溶液得到Mg(OH)2、H2和Cl2,D错。
答案:B
7.(2010·江苏卷)下列说法不正确的是( )
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱
解析:本题考查电化学、化学反应速率、离子的氧化性等知识,意在考查考生对化学基本理论的掌握情况。A项,铅蓄电池在放电过程中,负极和正极的质量均减小,故不正确;B项,正确;C项,催化剂可以改变化学反应速率,但不能影响化学平衡,即不能提高转化率,不正确;D项,正确。
答案:AC
6.(2010·四川省诊断性测试)下列说法中一定正确的是( )
A.周期表中同主族元素单质的熔点从上到下逐渐增高
B.12 g金刚石与8 g CH4所含共价键数目相等
C.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
D.若将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3和Na2SO3
解析:A项周期表中同主族元素单质的熔点从上到下不一定逐渐增高,例如金刚石的熔点比晶体硅的熔点高;C项中钢铁在海水中比在河水中更易腐蚀,主要原因是海水中含大量电解质;D项中Na2SO3溶液在蒸干并灼烧的过程中容易被空气中的氧气氧化生成Na2SO4。
答案:B
5.(2010·重庆市诊断性测试)有下列两种假设:①一种碱溶液与一种盐溶液混合反应后,生成一种强碱性物质;②两种酸溶液混合反应后,溶液的酸性减弱。其中确有具体例证存在的是( )
A.①② B.②
C.① D.都不存在
解析:①可能是Ca(OH)2与Na2CO3反应生成NaOH,②可能是HI与HNO3发生氧化还原反应。
答案:A
4.(2010·成都市检测)在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)⇌2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法不正确的是( )
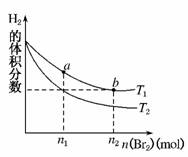
A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
解析:选项A,根据反应:H2(g)+Br2(g)⇌2HBr(g);ΔH<0,升温平衡向着逆反应方向移动,H2的体积分数增大,根据图示变化,可知T1>T2。选项B,b点Br2的浓度比a点Br2的浓度大,反应速率也大,正确。选项C,降低生成物HBr(g)的浓度,有利于平衡向着正反应方向移动,Br2(g)的转化率提高。选项D,体积不变时,在Br2(g)物质的量较多的情况下,平衡时HBr的体积分数可能减小。
答案:D
3.如图是元素周期表中短周期的一部分,B原子与C原子核外电子数之和是A的4倍。则下列推断正确的是( )
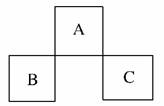
A.A、B、C三者均为非金属元素
B.A、B、C三者可以形成一种离子化合物
C.A、B、C三者核电荷数之和为32
D.B的氢化物比C的氢化物稳定
解析:设A原子的核外电子数为x,则B为(x+7)、C为(x+9),由题意知x+7+x+9=4x,解得x=8,确定A为氧元素、B为磷元素、C为氯元素。故A选项正确。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com