
题目列表(包括答案和解析)
10.(2010·东北三校一模)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.85 g NaCl晶体中含有氯化钠分子的数目为0.1 NA
B.25℃时,1 L pH=1的醋酸溶液中含有醋酸分子数大于0.1 NA
C.含0.1 mol FeCl3的饱和溶液中Fe3+数目为0.1 NA
D.6.25 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.1 NA
解析:氯化钠是离子晶体,晶体中不存在分子,A错;1 L pH=1的醋酸,已电离的醋酸分子数为0.1 NA,未电离的醋酸分子数远大于0.1 NA,B正确;含0.1 mol FeCl3的饱和溶液,由于Fe3+水解,Fe3+数目小于0.1 NA,C错;6.25 mL 16 mol·L-1的浓硫酸,n(H2SO4)=0.1 mol,由于随着反应的进行,硫酸的浓度逐渐变稀,稀硫酸不能与铜反应,故转移电子数小于0.1 NA,D错。
答案:B
9.(2010·四川省摸底考试)有电子转移的反应一定不是( )
A.化合物(Ⅰ)+化合物(Ⅱ)―→化合物(Ⅲ)+化合物(Ⅳ)
B.反应物总能量大于生成物总能量的反应
C.同素异形体之间的转化反应
D.相同条件下,同时向正反应方向和逆反应方向进行的反应
解析:有电子转移的反应一定是氧化还原反应。A项,若是复分解反应,则一定不是氧化还原反应,若是3NO2+H2O===2HNO3+NO,则一定是氧化还原反应,A项错误;B项,只能表明它是放热反应,可能是氧化还原反应也可能是非氧化还原反应,B项错误;同素异形体之间的转化过程中元素化合价没有变化,C项正确;相同条件下,同时向正、逆方向进行的反应是可逆反应,可逆反应可能是非氧化还原反应,D项错误。
答案:C
8.(2010·北京市检测)若两物质恰好完全反应,下列各项中反应前后保持不变的是( )
①电子总数 ②原子总数 ③分子总数 ④物质的总能量 ⑤物质的总质量
A.①②⑤ B.①③⑤
C.②③④ D.②④⑤
解析:化学反应前后物质的电子总数、原子总数、物质的总质量是守恒的,而分子总数可能发生变化,物质的总能量一定发生变化。
答案:A
7.(2010·江西省模拟)有关化学反应:Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2的叙述正确的是( )
A.HNO3只体现酸性
B.氧化产物只有Zn(NO3)2,还原产物只有N2
C.还原产物与氧化产物物质的量之比为1?2
D.生成1 mol N2转移电子总数为3.01×1024
解析:A项中硝酸既体现氧化性又体现酸性;B项中氮气和硝酸锌都是氧化产物;C项中还原产物和氧化产物物质的量之比为1?3。
答案:D
6.(2010·郑州市质量预测)传统的自来水消毒常采用漂白粉等强氧化剂,但其产生的有机氯对人体有一定的危害。一种新型的消毒剂--高铁酸盐(如Na2FeO4或K2FeO4)能有效地杀灭水中的细菌和病毒,同时其产物在水中经过变化后能除去水中的微细悬浮物。在以上变化过程中不可能涉及的变化有( )
A.电离 B.水解
C.置换反应 D.氧化还原反应
解析:在用Na2FeO4(K2FeO4)消毒净水的过程中,首先是Na2FeO4(K2FeO4)电离产生Na+(K+)和FeO,然后是FeO表现氧化性,杀灭水中的细菌和病毒,而本身被还原为Fe3+,Fe3+在水中水解,生成Fe(OH)3胶体,吸附悬浮物使之沉降而除去,所以本题答案为C。
答案:C
5.(2010·河南省调研)同温同压下,A容器中的H2和B容器中的NH3所含氢原子数相等,则两个容器的体积比是( )
A.3:2 B.1:3
C.2:3 D.1:2
解析:由题意知氢气与氨气的物质的量之比为3?2,根据阿伏加德罗定律,同温同压下体积之比等于物质的量之比,A正确。
答案:A
4.(2010·北京市检测)分类方法在化学学科的发展中起到了重要的作用。下列分类标准合理的是( )
A.根据纯净物的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
解析:选项B,根据电解质能否完全电离,将电解质分为强电解质和弱电解质。选项C,分散系的分类依据是分散质微粒大小,而不是是否具有丁达尔效应。选项D,根据反应中的能量变化,将反应分为吸热反应和放热反应。
答案:A
3.(2010·四川省摸底考试)下列每组物质分别存在于同一化学反应中,其中化学方程式中H2SO4的化学计量数最大的是( )
A.H2O、KMnO4、FeSO4、H2SO4(稀)、Fe2(SO4)3、MnSO4、K2SO4
B.KMnO4、O2、H2O2、H2SO4(稀)、H2O、K2SO4、MnSO4
C.KMnO4、H2O、H2SO4(稀)、K2SO4、MnSO4、SO2
D.H2C2O4、KMnO4、K2SO4、MnSO4、CO2、H2O、H2SO4(稀)
解析:A项各物质间反应的方程式为2KMnO4+10FeSO4+8H2SO4===K2SO4+2MnSO4+5Fe2(SO4)3+8H2O;B项各物质间反应的方程式为2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O;C项各物质间反应的方程式为2KMnO4+5SO2+2H2O===K2SO4+2MnSO4+2H2SO4;D项各物质间反应的方程式为2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O。
答案:A
2.(2010·唐山市联考)下列有关化学用语使用正确的是( )
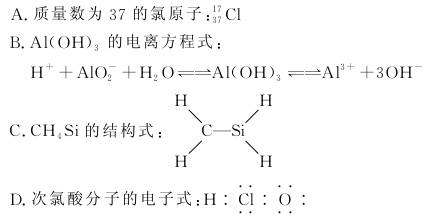
解析:质量数是37的氯原子表示为Cl,A错;氢氧化铝既能发生酸式电离,又能发生碱式电离,B正确;C、Si都是第ⅣA族元素原子,在分子中应该满足四键原则,故CH4Si的结构式中C原子与Si原子之间是双键,即CH4Si可以认为Si取代了乙烯分子中的一个碳原子,C错;次氯酸分子的电子式是:H?····?····?,D错。
答案:B
1.(2010·山东卷)16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
A.16O2与18O2互为同分异构体
B.16O与18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12 L16O2和1.12 L18O2均含0.1 NA个氧原子
解析:本题考查阿伏加德罗常数及同位素的概念,意在考查考生的分析推理能力和实际运用知识的能力。同分异构体是指分子式相同而结构不同的化合物,A选项错误;16O和18O互为同位素,质子数相同,电子数相同,所以两者的核外电子排布方式相同,B选项错误;16O和18O都是氧原子,而化学变化中的最小微粒是原子,所以化学变化不能实现16O和18O的转化,C选项错误;标况下,1.12 L16O2和1.12 L18O2的物质的量均为0.05 mol,则所含氧原子均为0.1 mol,D选项正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com