
题目列表(包括答案和解析)
6.(2010·江西省联考)下列实验操作或对实验事实的叙述不正确的是( )
A.用硝酸银溶液可以区分二氧化氮和溴蒸气
B. 酒精灯碰倒洒出酒精着火,迅速用湿抹布扑盖
C. 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
D. 检验氯代烃中的氯元素时,可先加氢氧化钠溶液加热,再加入硝酸溶液,最后加入硝酸银溶液来进行检验
解析:温度计摔坏导致水银散落到地面上,为防止其挥发,通常撒上硫粉。
答案:C
5.(2010·湖北省八校联考)在化学实验操作中,往往由于读数不规范导致较大的实验误差。下列有关实验中,会导致所配制(或所测定)溶液浓度偏大的是(其他操作均正确)( )
A.配制500 mL 1 mol/L稀硫酸实验中,用量筒量取18 mol/L浓硫酸时俯视读数
B. 配制100 mL 5 mol /L氯化钠溶液实验中,定容时仰视读数
C. 用标准盐酸滴定待测NaOH溶液的实验中,使用碱式滴定管开始平视,后来俯视读数
D. 用标准NaOH溶液滴定待测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数
解析:选项A,用量筒量取18 mol·L-1浓H2SO4时俯视读数导致量取浓H2SO4的体积减小,结果偏低。选项B,定容时仰视读数导致液体超过标线,结果偏低。选项D,读数开始时平视,后来俯视,导致所得标准溶液体积偏小,结果偏低。
答案:C
4.(2010·广东卷)对实验Ⅰ-Ⅳ的实验现象预测正确的是( )
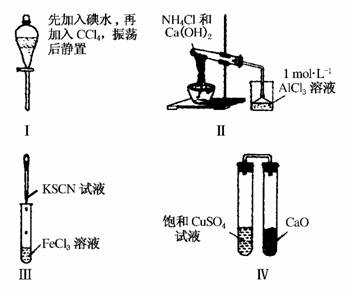
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液颜色变为红色
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
解析:本题考查化学实验,意在考查考生对化学实验的操作和分析能力。实验Ⅰ中振荡静置,由于碘在CCl4中的溶解度大于在水中的溶解度,又CCl4的密度大于水的密度且二者互不相溶,故上层为水,几乎无色,下层为碘的四氯化碳溶液,显紫红色,A项错误;实验Ⅱ中NH4Cl和Ca(OH)2共热时生成NH3,NH3通入AlCl3溶液中产生Al(OH)3白色沉淀,但沉淀不溶于氨水,B项错误;实验Ⅲ中Fe3+遇到SCN-显红色,C项正确;实验Ⅳ中右边试管中CaO能够吸收左边试管中的水汽并与水反应,因此左边试管中饱和硫酸铜溶液中有蓝色晶体析出,D项正确。
答案:CD
3.(2010·四川省绵阳市诊断性测试)下列实验方法能达到目的的是( )
A.用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液
B. 用饱和Na2CO3溶液除去乙醇中少量的乙酸和水
C. 取皂化反应后的混合液滴入水中,判断皂化反应是否完全
D. 用氨水清洗试管内壁附着的银镜
解析:A项中Ca(OH)2和NaHCO3溶液相互滴加产生的现象一样,故不能通过相互滴加的方法来鉴别;B项中由于乙醇与水混溶,故不能用饱和Na2CO3溶液除去乙醇中少量的乙酸和水;D项中氨水与Ag单质不反应,氨水不能清洗试管内壁附着的银镜,通常用硝酸来清洗。
答案:C
2.(2010·四川省绵阳市诊断性测试)玻璃棒是化学实验中常用的仪器,下列有关实验过程需要使用玻璃棒进行操作的是( )
①用pH试纸测定溶液的pH ②将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体 ③从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl ④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验 ⑤用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验 ⑥实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
A.①②⑥ B.③④⑥
C.②④⑤ D.①③⑤
解析:①需用玻璃棒蘸取待测液来测定其pH;③分离MnO2、KCl混合物时需过滤,过滤用玻璃棒进行引流;⑤需用玻璃棒进行搅拌,使反应更充分。
答案:D
1.(2010·江西省五校联考)下列实验操作示意图所示的实验操作正确的是( )
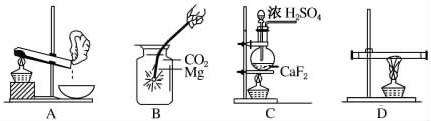
A.加热结晶水合物 B.镁条在二氧化碳里燃烧
C.制备较纯净的HF D.红磷转变成白磷
解析:选项A,在试管中加热结晶水合物会导致受热不均匀出现事故,应在坩埚内加热结晶水合物,加热时要用玻璃棒不断搅拌。选项B,集气瓶底部垫上细沙能防止因生成物温度过高而使集气瓶破裂,正确。选项C,生成的氢氟酸要腐蚀烧瓶。选项D,不能将玻璃管两端都堵住。
答案:B
0.5 a
n(O2) 2n(O2)a
则n(CH3OH)(E2-E1)=2n(O2)a,
即n(CH3OH):n(O2)=2a/(E2-E1),
则n(CH3OH):n(空气)=2a/5(E2-E1)。
22.(2009·安徽)(10分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
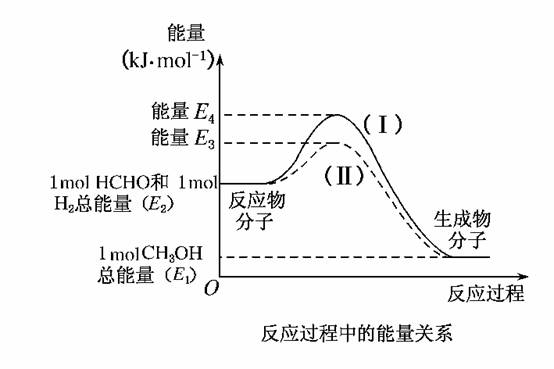
(1)甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
(2)过程Ⅰ与过程Ⅱ的反应热是否相同?________,原因是____________________________________________________________。
(3)写出甲醇催化脱氢转化为甲醛的热化学反应方程式______________________________________________。
(4)甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700°C,需向体系中通入空气,则进料甲醇与空气的物质的量理论比值为多少?[假设:H2(g)+O2(g)H2O(g);ΔH=-akJ·mol-1,空气中氧气体积分数为0.2]
答案:(1)吸热 (2)相同 一个化学反应的反应热仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关
(3)CH3OH(g)HCHO(g)+H2(g);ΔH=(E2-E1)kJ·mol-1
(4)CH3OH(g)HCHO(g)+H2(g);ΔH=(E2-E1)kJ·mol-1
1 (E2-E1)
n(CH3OH) n(CH3OH)(E2-E1)
H2(g)+O2(g)H2O(g);ΔH=-akJ·mol-1
21.(2010·石家庄质检(一))(6分)已知几种离子的还原能力强弱顺序为I->Fe2+>Br-。
(1)向含1 mol FeI2和2 mol FeBr2的溶液中通入3 mol Cl2后,溶液中各种离子的物质的量之比是________(不计H+和OH-)。
(2)向40 mL FeBr2溶液中通入0.672 L Cl2(标准状况),充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,求原FeBr2溶液的物质的量浓度(要求写出简单的计算过程)。
解析:(1)根据题意知,离子的还原性顺序是I->Fe2+>Br-,故通入氯气时先氧化I-,然后氧化Fe2+,最后才氧化Br-,当通入3 mol Cl2后,先氧化全部I-、Fe2+,最后再氧化1 mol Br-,故溶液中除了H+、OH-外,剩余Br- 3 mol,生成Fe3+3 mol,生成Cl- 6 mol,故n(Fe3+)?n(Br-)?n(Cl-)=1?1?2。
(2)n(Cl2)=0.672 L÷22.4 L·mol-1=0.03 mol
所以n(Cl-)=0.03 mol×2=0.06 mol
n(Br-)=0.06 mol
由题意可推知,反应后溶液中的Fe2+全部转化为Fe3+
由电荷守恒得:n(Fe3+)=0.06 mol×2÷3=0.04 mol
根据铁元素守恒得:n(FeBr2)=n(Fe3+)
∴c(FeBr2)=0.04 mol÷0.04 L=1 mol·L-1。
答案:(1)n(Fe3+)?n(Br-)?n(Cl-)=1?1?2
(2)解:n(Cl2)=0.672 L÷22.4 L·mol-1=0.03 mol
所以n(Cl-)=0.03 mol×2=0.06 mol
n(Br-)=0.06 mol
由题意可推知,反应后溶液中的Fe2+全部转化为Fe3+
由电荷守恒得:n(Fe3+)=0.06 mol×2÷3=0.04 mol
根据铁元素守恒得:n(FeBr2)=n(Fe3+)
∴c(FeBr2)=0.04 mol÷0.04 L=1 mol·L-1。
0.(4)0.004
(5)016 17
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com