
题目列表(包括答案和解析)
5.如图所示,将甲、乙两烧杯用导线相连,Pt、Cu、C、Zn分别为四个电极,当开关闭合后,以下叙述不正确的是( )
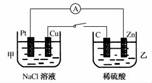
A.甲是电解池,乙是原电池
B.电子流向是由Pt电极流向Zn电极
C.工作一段时间后,甲池有蓝色沉淀生成
D.当C电极上有4 mol电子转移时,Zn电极上有2 mol H2生成
解析:开关闭合后,乙装置中发生自发进行的氧化还原反应,是原电池,Zn电极为负极,C电极为正极;甲装置是电解池,Pt电极为阴极,Cu电极为阳极。电子流向是由Zn电极流向Pt电极,B错。
答案:B
4.(2010·云南省摸底考试)二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。下列有关说法正确的是( )
A.电池中二甲醚反应后最终转化为CO2和H2O
B.正极:3O2+12e-+12H+===6H2O
C.负极:CH3OCH3+16OH--12e-===2CO+11H2O
D.负极:CH3OCH3-12e-+3H2O===12H++2CO2
解析:CO2能与KOH溶液反应,A、D错;介质呈碱性,反应物中不应存在H+,B错。
答案:C
3.(2010·四川省摸底考试)已知金属离子的氧化性:Cu2+>Ni2+>Fe2+>Zn2+。金属镍有广泛用途,粗镍中含有少量的Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni
B.电解过程中,阳极减少的质量等于阴极增加的质量
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有铜和铂两种金属单质
解析:电解池中阳极发生氧化反应,电极反应为Ni-2e-===Ni2+、Zn-2e-===Zn2+、Fe-2e-===Fe2+,A项错误;阳极镍、铁、锌都溶解,而阴极只析出镍,故阳极减少的质量不等于阴极增加的质量,B项错误;镍精炼实验中的电解质溶液是镍盐,溶液中存在Ni2+、Fe2+、Zn2+,C项错误;铜、铂没有溶解,D项正确。
答案:D
2.(2010·桂林市摸底考试)如右图所示,a、b两电极材料分别为铁丝和铜丝。则以下说法不正确的是( )
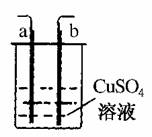
A.该装置可以构成原电池,也可以构成电解池
B.a电极可能发生反应:Cu2++2e-===Cu
C.b电极质量可能增加
D.该过程可能有大量气体产生
解析:该装置若用导线直接相连,则构成原电池,若与电源相连,则构成电解池,A对;当a电极作电解池的阴极时,其电极反应为Cu2++2e-===Cu,B对;当b电极作原电池的正极时,电极反应为Cu2++2e-===Cu,C对。
答案:D
1.将铝片和镁片用导线连接后,分别插入盛有NaOH溶液的P烧杯与盛有稀盐酸的Q烧杯中,下列叙述正确的是( )
A.P、Q中,均是镁作负极
B.两个电池工作时,P中铝片发生氧化反应,Q中镁片发生氧化反应
C.正极上的电极反应均是2H++2e-===H2↑
D.两个电池工作时,负极失去的电子均通过溶液转移到正极上
解析:由于镁与NaOH溶液不反应而铝能,故P中是铝片作负极,镁、铝均能与盐酸反应,镁比铝活泼,故Q中镁片作负极,而负极均是失去电子发生氧化反应,A错B对;P中溶液呈碱性,不可能有大量氢离子得到电子,C错;电子是通过导线转移到正极的,D错。
答案:B
20.(12分)(2010·广东卷)某研究小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH===__________________________________。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为________。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO,请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设。
假设1:只存在SO;
假设2:既不存在SO,也不存在ClO-;
假设3:_______________________________。
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。
限选实验试剂:3 mol·L-1 H2SO4、1 mol·L-1 NaOH、0.01 mol·L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量吸收液于试管中,滴加3
mol·L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 |
|
|
步骤2: |
|
|
步骤3: |
|
解析:本题主要考查实验设计与评价能力,背景知识为氧化还原反应,意在考查考生的实验设计能力,分析与解决问题的能力,本题在对考生实验评价能力的考查上具有特别的价值,是一个既具有新颖性,又不失经典性的好题。(1)SO2与过量NaOH反应的产物为Na2SO3与H2O;(2)在反应中,硫元素的化合价升高,所以Na2SO3为还原剂;(3)SO具有较强的还原性,而ClO-具有极强的氧化性,ClO-与SO是不能共存的,所以假设3为:只存在ClO-,实验设计只要求证实酸化后的溶液是具有氧化性,还是具有还原性,还是既不具有氧化性,也不具有还原性,若加入淀粉-KI溶液会出现蓝色,证明存在ClO-,若加入KMnO4溶液时,KMnO4溶液褪色,证明存在SO,若两种现象均无,则假设2成立。
答案:(1)Na2SO3+H2O (2)Na2SO3
(3)①只存在ClO-
②
|
步骤2:向A试管中滴加1-2滴0.01
mol·L-1
KMnO4溶液。 |
(ⅰ)若溶液褪色,则假设1成立; (ⅱ)若溶液不褪色,则假设2或3成立。 |
|
步骤3:向B试管中滴加1-2滴淀粉-KI溶液。 |
(ⅰ)若溶液变蓝色,则假设3成立; (ⅱ)若溶液不变蓝色,结合步骤2中的(ⅱ),则假设2成立。 |
2.(2)搅拌
(3)5×10-5
(4)反应物浓度增大反应速度加快或反应速率变化和反应物起始浓度变化存在比例关系或反应物浓度对反应速率的影响和化学计量数无关等
Ⅱ.(1)①Na2S溶液、Na2CO3溶液 ②NaOH溶液
(2)沉淀逐渐消失
(3)加热浓缩、冷却结晶、过滤
19.(18分)(2010·北京市海淀区期中)Ⅰ.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
[实验原理]
(NH4)2S2O8和KI反应的离子方程式为:
S2O+2I-===2SO+I2 ①
平均反应速率的计算式为v(S2O)=。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应①进行的同时,发生反应:
2S2O+I2===S4O+2I- ②
反应①生成的I2立即与S2O反应,生成无色的S4O和I-。S2O耗尽时,反应①继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
[实验内容]
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
|
试剂用量(mL) |
0.20 mol·L-1(NH4)2S2O8溶液 |
20.0 |
10.0 |
b_ |
20.0 |
20.0 |
|
0.20
mol·L-1KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
|
0.010 mol·L-1Na2S2O3溶液 |
a_ |
8.0 |
8.0 |
8.0 |
8.0 |
|
|
0.2%
淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
|
0.20
mol·L-1KNO3溶液 |
0 |
0 |
0 |
10.0 |
c_ |
|
|
0.20 mol·L-1(NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
|
20℃时,反应时间Δt(s) |
32 |
67 |
130 |
66 |
135 |
|
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变。 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是________。
(3)第①组实验的v(S2O)=________mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)__________________________________________。
Ⅱ.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
Na2CO3+SO2===Na2SO3+CO2
2Na2S+3SO2===2Na2SO3+3S↓
Na2SO3+S===Na2S2O3
该小组根据上述原理设计如图所示装置制备Na2S2O3。
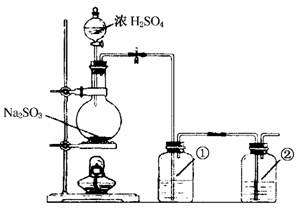
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是①____________;②____________。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是________________。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:__________________。
解析:Ⅰ.(1)对题中实验记录表和数据记录进行分析,第②、④组实验中溶液的总体积为50 mL,为了保持溶液的总体积不变,故a为8.0;b为5.0;c为15.0。(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行搅拌。(3)第①组实验的v(S2O)=0.010 mol·L-1×0.008 L×/(0.05 L×32 s)=2.5×10-5mol·(L·s)-1。(4)本题答案较开放,根据表中数据分析,可以得到的结论有:反应物浓度增大反应速率加快;反应速率变化和反应物起始浓度变化存在比例关系;反应物浓度对反应速率的影响和化学计量数无关等。
Ⅱ.(1)①中盛放Na2S溶液、Na2CO3溶液;多余的尾气用NaOH溶液吸收,即②为NaOH溶液。(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,Na2SO3与S反应生成Na2S2O3,可以观察到的现象是沉淀逐渐消失。(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:加热浓缩、冷却结晶、过滤。
答案:Ⅰ.(1)a 8.0 b 5.0 c 15.0
18.(10分)(2010·北京市东城区检测)某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答下列问题:
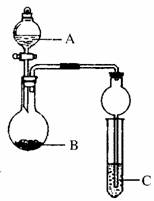
(1)若A为浓氨水,B为烧碱,C为AlCl3溶液,打开分液漏斗旋塞,烧瓶中即有氨气生成,原因是_________________________(结合离子方程式回答)。一段时间后,观察到试管中的现象是___________,发生反应的离子方程式是____________________。
(2)利用该装置设计实验证明醋酸、碳酸、苯酚的酸性强弱,若B为碳酸钠,C为苯酚钠溶液,A与B发生反应的离子方程式是______________________,得到的相应结论是______________;试管中出现浑浊,依据此现象能否得出相应的结论,并简述理由:________________________________。
答案:(1)在氨水中存在下列平衡:NH3+H2OƒNH3·H2OƒNH+OH-,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动 有白色沉淀产生 Al3++3NH3·H2O===Al(OH)3↓+3NH
(2)CO+2CH3COOH===2CH3COO-+H2O+CO2↑ 醋酸的酸性强于碳酸 不能,因为醋酸具有挥发性,挥发出的醋酸可以和苯酚钠溶液发生反应,生成苯酚
17.(12分)(2010·武汉市调研)甲、乙两个化学兴趣小组利用下列仪器装置完成有关实验。根据要求回答问题。
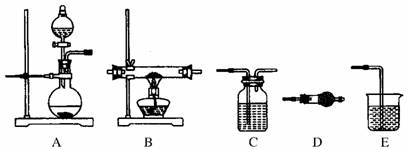
(1)甲组同学验证H2的还原性并检验其氧化产物。仪器连接顺序为(括号内为对应装置中的药品):
ACB―→
(锌粒、稀硫酸)(浓硫酸) (CuO)
DDE
(无水CuSO4)(碱石灰)(加洗涤剂的水)
①在A中发生反应时,常加入少量CuSO4溶液,其作用是_________________________________________。
②列举一条能证明H2具有还原性的实验现象_________________________________________。
③点燃B处酒精灯前必须检验氢气的纯度,通过用燃着的木条点燃E中泡沫就可以达到目的。用这种方法检验氢气纯度的优点是___________________________________________。
(2)乙组同学选择A、C、D装置,制取少量SO2气体并探究其还原性。
①装置A中制备SO2应放入的试剂是________(用字母表示);
a.10%稀硫酸 b.70%浓硫酸 c.稀硝酸
d.Na2SO3固体 e.Na2SO3溶液
②为了证明SO2具有还原性,装置C中可放入H2O2与BaCl2的混合溶液,实验现象为________________________;该过程中发生反应的化学方程式是________________________。
③装置D中可放入的药品为________。
解析:(1)①中加入少量硫酸铜,CuSO4与Zn发生置换反应,形成Cu-Zn原电池加快反应速率;②B中的黑色氧化铜变成红色铜或D中无水CuSO4固体变蓝色,能说明H2有还原性;③通过点燃E中的泡沫来验证H2的纯度,比在空气中点燃验证H2的纯度要安全。
(2)①选用固体和液体药品相结合的形式,故要用亚硫酸钠固体,硝酸有强氧化性,SO2在稀硫酸中有一定的溶解度,故液体用70%的浓硫酸。②装置C中通入的SO2与H2O2、BaCl2反应生成硫酸钡沉淀。③装置D用来吸收SO2,故可以加入碱石灰等碱性物质。
答案:(1)①Zn与CuSO4溶液发生置换反应,形成Cu-Zn原电池,加快了反应速率
②B中的黑色固体慢慢变成红色或D中无水CuSO4白色固体变蓝色(答出任意一条即可。其他合理答案也给分)
③无需收集气体可直接检验H2的纯度,操作简单,安全性好
(2)①b、d
②C装置中出现白色沉淀 H2O2+SO2===H2SO4,H2SO4+BaCl2===BaSO4↓+2HCl或者写成H2O2+SO2+BaCl2===BaSO4↓+2HCl
③碱石灰或CaO或NaOH(其他合理答案也给分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com