
题目列表(包括答案和解析)
3.(2010·东北地区联考)由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20。则有关X的下列说法中正确的是( )
A.X中阳离子和阴离子个数一定相等
B.X中可能既含离子键,又含共价键
C.若X只含两种元素,则两种元素可在同一周期也可在同一主族
D.X中阳离子半径一定大于阴离子半径
解析:这是一道开放性很好的试题。首先要熟悉常见的10电子微粒,如N3-、O2-、F-以及OH-等阴离子,Na+、Mg2+、Al3+以及NH等阳离子。因此符合题意的微粒很多,如Na3N、Mg3N2、NaF、MgF2、AlF3、Na2O、MgO、Al2O3、NH4F、NaOH等均符合试题条件。故X中阳离子和阴离子个数不一定相等,A错误;NaOH、NH4F中既含离子键,又含共价键,故B正确;一个阳离子和一个阴离子核外电子数之和为20,且两种元素在同一主族的物质有KH,但K不是短周期元素,C错误;等电子离子的半径,随核电荷数增大而减小,故阳离子半径小于阴离子半径,D错误。
答案:B
2.(2010·潍坊市抽样)核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数和中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A.18O 31P
B.19F 12C
C.元素周期表中ⅢA族所有元素的原子
D.元素周期表中第三周期元素的所有原子
解析:18O的质子数、中子数分别为8、10,均为偶数,不能产生NMR现象,A错;12C的质子数、中子数均为6,均为偶数,不能产生NMR现象,B错;元素周期表中ⅢA族元素的原子其质子数均为奇数,均可产生NMR现象,C对;元素周期表中第三周期元素的24Mg、28Si、32S、40Ar等原子其质子数和中子数均为偶数,不能产生NMR现象,D错。
答案:C
1.(2010·潍坊市模拟)3He可以作为核聚变材料,以下关于3He的说法正确的是( )
A.比4He少一个质子
B.比4He多一个中子
C.与4He互为同分异构体
D.与4He互为同位素
解析:3He和4He的质子数均为2,A错;3He和4He的中子数分别为1、2,B错;3He和4He为氦元素的两种不同原子,互为同位素,C错、D对。
答案:D
13.(2010·武昌调研)有甲、乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g)⇌xC(g)。①向甲中通入4 mol A、2 mol B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
(1)若W%=40%,且建立平衡的过程中乙的压强有变化,则x=________。
(2)若W%=40%,且平衡时甲、乙的压强不同,则乙中平衡时c(A)=________。
(3)若x=4,则W%________40%(填“大于”、“小于”或“等于”)。
解析:(1)甲、乙为等效平衡,建立平衡的过程中乙的压强有变化,说明反应前后气体分子数不相等,则通过化学计量数换算成相同物质的浓度相等,根据化学方程式,3 mol C等效于mol A和mol B,故+1=4,解得x=2。(2)甲、乙为等效平衡,由于平衡时甲、乙压强不同,则反应前后气体分子数相等,故x=3。假设乙平衡建立过程中C转化的物质的量为n mol,则平衡时A、B、C的物质的量分别为(1+n)mol、(0.5+n)mol、(3-n)mol,则×100%=40%,解得n=1.2,故平衡时n(A)=1+×1.2=1.8(mol),c(A)=1.8 mol/L。(3)若x=4,则乙中等效于起始时通入2.5 mol A和1.25 mol B,相对于甲,乙中压强减小,平衡向正反应方向移动,因此C的体积分数增大,故W%大于40%。
答案:(1)2 (2)1.8 mol/L (3)大于,,
12.(2010·北京市东城区检测)一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)⇌CH3OH(g)达到化学平衡状态。
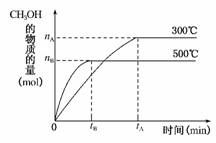
(1)500℃时,从反应开始到达到化学平衡状态,以H2的浓度变化表示的化学反应速率是________(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是________(填字母)。,a.v生成(CH3OH)=v消耗(CO),b.混合气体的密度不再改变,c.混合气体的平均相对分子质量不再改变,d.CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。,a.c(H2)减小,b.正反应速率加快,逆反应速率减慢,c.CH3OH的物质的量增加,d.重新达到平衡时,c(H2)/c(CH3OH)减小
解析:(1)0-tB时间内,生成nB mol CH3OH,则消耗2nB mol H2,则Δc(H2)=2nB/3 mol/L,v(H2)=2nB/(3tB)mol·L-1·min-1。,(2)选项a,任何时刻都有v生成(CH3OH)=v消耗(CO)。选项b,因混合气体的体积不变,混合气体的质量不变,任何时刻混合气体的密度都保持不变。选项c,根据=,m气体总不变,不变,说明n气体总不变,所以反应达到了平衡状态。选项d,各种物质的浓度不变,也说明了反应已达到平衡状态。,(3)压缩容器容积相当于增大体系压强,则平衡向着正反应方向移动,正、逆反应速率都增大,但由于容积缩小为原平衡的,达新平衡时c(H2)比原平衡时的大,由于平衡向正反应方向移动,重新达到平衡时c(H2)/c(CH3OH)减小,所以选项a、b错误,c、d正确。
答案:(1)mol·L-1·min-1 (2)cd (3)cd
11.已知某反应A(g)+B(g)⇌C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
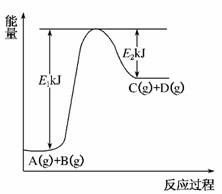
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。,(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。,(3)在相同温度和压强下,对反应A(g)+B(g)C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
,
|
|
A |
B |
C |
D |
|
甲 |
a mol |
a mol |
0 |
0 |
|
乙 |
2a mol |
a mol |
0 |
0 |
|
丙 |
a mol |
a mol |
a mol |
a mol |
|
丁 |
a mol |
0 |
a mol |
a mol |
上述四种情况达到平衡后,n(C)的大小顺序是________。
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是________。
A.气体平均摩尔质量不再变化
B. 气体压强不再变化
C. 气体密度不再变化
D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1
F. C生成的速率等于B消耗的速率
解析:(2)使用催化剂可以降低反应所需要的能量,但不影响反应的反应热;(3)依题意,四组实验中,温度、压强相等,容器的容积不一定相等。采用“一边倒”法,将产物转化成起始反应物,列表如下:,
|
|
A |
B |
C |
D |
|
甲 |
a
mol |
a
mol |
0 |
0 |
|
乙 |
2a
mol |
a
mol |
0 |
0 |
|
丙 |
2a
mol |
2a
mol |
0 |
0 |
|
丁 |
2a mol |
a
mol |
0 |
0 |
等温等压下,起始物质投料物质的量(物质的量浓度)之比相同,达到同一平衡状态。根据表格数据知,甲和丙达到同一平均状态;乙和丁达到同一平衡状态。乙平衡状态,可以看成甲达到平衡后,向体系中增大A的浓度,平衡向右移动,C浓度增大。所以,达到平衡时,C的物质的量:乙=丁>甲=丙。
答案:(1)E1-E2 (2)减小 不变 (3)A (4)升高温度、增加B的浓度 (5)D
10.在一定容积的密闭容器中发生反应:X(g)+Y(g)⇌Z(g)+W(s);ΔH>0。若开始投入1 mol X和1 mol Y,在一定条件下达到平衡,改变条件,其变化关系符合甲、乙图象。,下列有关判断正确的是( )

A.甲图表示温度对X转化率的影响,且Ⅰ温度较低
B.乙图一定表示压强对X体积分数的影响,且Ⅳ压强较高
C.甲图一定表示压强对X体积分数的影响,且Ⅰ压强较高
D.甲、乙图都可以表示温度、压强对平衡的影响,且Ⅰ>Ⅱ,Ⅲ<Ⅳ
解析:W为固态,该可逆反应的正反应是气体体积减小的吸热反应。若甲图表示压强对平衡的影响,根据先拐先平数值大,Ⅰ的压强较大,Ⅱ到Ⅰ(增大压强),平衡向右移动,X的转化率增大;若甲图表示温度对平衡影响,则Ⅰ的温度较高,Ⅱ到Ⅰ(升温),平衡向正方向移动,X的转化率增大,均符合题意。同理,乙图也可以表示温度、压强对平衡的影响,且Ⅳ一定大于(或高于)Ⅲ,只有D项正确。
答案:D
9.在相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)⇌2NH3(g);ΔH=-92.6 kJ/mol,实验测得起始与平衡时有关数据如下表所示:,
|
实验编号 |
起始时各物质的量/mol |
达到平衡时体系 能量的变化 |
||
|
N2 |
H2 |
NH3 |
||
|
① |
1 |
3 |
0 |
23.15
kJ |
|
② |
0.9 |
2.7 |
0.2 |
Q |
下列叙述错误的是( )
A.达到平衡时两容器中压强相同
B.平衡时两容器内NH3的体积分数均为
C.平均时容器②中Q=23.15 kJ
D.若容器①的容积为0.5 L,则平衡时放出的热量小于23.15 kJ
解析:将容器②中NH3的量转化为N2、H2后知,两个容器中相同的物质起始量相同,故它们可构成恒容条件下的等效平衡,平衡时两容器内各物质的量对应相等,A对;但通过反应生成NH3的量容器②的比①的少,故②中反应放出的热量少于23.15 kJ,C错;当容器容积扩大时,相当于减小压强,平衡向左移动,放出的热量减少,D对;由热化学方程式及平衡时放出的热量数值知,平衡时生成了0.5 mol NH3,混合气体共为3.5 mol,故B对。
答案:C
8.(2010·赣州市质检)在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g)⇌xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
A.2 B.3
C.可能是2,也可能是3 D.无法确定
解析:根据恒温恒容条件下的等效平衡规律:对于反应前后气体的分子数不等的可逆反应,只要通过化学计量数换算成相同物质时浓度相等,就可以建立等效平衡;对于反应前后气体的分子数相等的可逆反应,只要通过化学计量数换算成相同物质时浓度之比与原来相等,就可以建立等效平衡。当x为2或3时,均能成立。
答案:C
7.(2010·邯郸摸底考试)某密闭容器中充入等物质的量的气体A和B,在一定压强和温度下发生反应:A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确的是( )
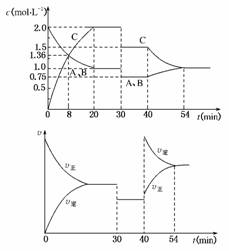
A.30 min时降低温度,40 min时升高温度
B. 0-8 min内A的平均反应速率为0.08 mol·L-1·min-1
C. 反应方程式中的x=1,正反应为吸热反应
D. 54 min时C的体积分数大于40 min时
解析:根据时间-浓度变化图,20 min时反应达到平衡,此时A、B浓度减小1 mol·L-1,C的浓度为2 mol·L-1,推知x=1,则有:A(g)+B(g)⇌2C(g)。根据时间-速率图象,30 min时,正、逆反应速率降低,但平衡没有移动,不可能是降低温度引起的,可能是减小压强。40 min时改变条件导致正、逆反应速率均增大,但40 min瞬间A、B、C的浓度均不变,故改变的条件是升高温度。又因为逆反应速率增大的倍数大于正反应,平衡向逆反应方向移动,故54 min达到平衡时,C的体积分数小于40 min时,且推知反应为放热反应。0-8 min内,Δc(A)=2.0 mol·L-1-1.36 mol·L-1=0.64 mol·L-1,Δt=8 min,故v(A)=0.08 mol·L-1·min-1。综合上述,选项B正确。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com