
题目列表(包括答案和解析)
13.(2010·西安地区名校联考)短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是:________(用离子符号表示)。
(2)指出元素D在元素周期表中的位置:第________周期第________族。
(3)元素B的氧化物属于________化合物(填“离子”或“共价”),其电子式为________。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为________________。
(5)含有C阳离子的盐常用来净化水,其原因为________________________________________。(用离子方程式和适当的文字说明)
答案:(1)Na+>Mg2+>Al3+
(2)三 ⅥA
(3)离子 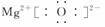
(4)OH-+Al(OH)3===AlO+2H2O
(5)Al3++3H2O Al(OH)3(胶体)+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的
Al(OH)3(胶体)+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的
12.(2009·东城区模拟)下列关于晶体的说法正确的组合是( )
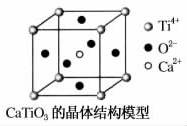
(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示),每个Ti4+和12个O2-相紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
解析:可用例举法一一排除,稀有气体构成的分子晶体中无共价键,①错;构成金属晶体的粒子是金属阳离子和自由电子,由此可知选项②错;在离子晶体NaOH中既有离子键,又有共价键,④错;SiO2是原子晶体,形成空间网状结构,每个硅原子与4个氧原子以共价键相结合,⑥错;分子的稳定性与分子内的共价键有关,与晶体中分子间作用力无关,⑦错。
答案:D
11.(2009·东北师大附中模拟)下面图像是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的是( )
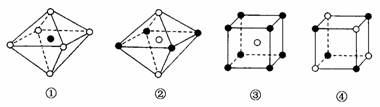
A.①和④ B.②和③
C.①和③ D.只有①
解析:在NaCl晶体中,1个Na+周围有6个距离相等且最近的Cl-,这6个Cl-围成正八面体结构。
答案:A
10.(2010·黄冈市质检)X、Y、Z是三种短周期元素,在周期表中的相对位置如图所示,有关说法正确的是( )
|
X |
|
|
Y |
Z |
A.X、Y、Z可以都是金属
B.原子半径:Z>Y>X
C.最高价氧化物对应的水化物酸性:Z>Y>X
D.若X、Y、Z可形成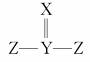 分子,则其中各原子都满足8电子结构
分子,则其中各原子都满足8电子结构
解析:A项,正确,如X为Li,Y为Na,Z为Mg;B项,同周期从左到右原子半径逐渐减小,则原子半径为Y>Z,故不正确;C项,若X、Y、Z是非金属元素,则非金属性Y最弱,故最高价氧化物对应水化物的酸性也是Y最弱,不正确;D项,若Z满足8电子结构(只需1根键),则Y只需形成2根键就满足8电子结构,现为4根键,故不正确。
答案:A
9.(2010·桂林市摸底考试)下列说法中,正确的是( )
A.前三周期元素形成的单质中,常温下呈气态的有5种
B.ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.主族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.所有主族元素的正化合价数,等于它的族序数
解析:A项,前三周期元素形成的单质中,常温下呈气态的有8种;B项,正确;C项,一般主族元素的阳离子与上周期稀有气体原子的核外电子排布相同;D项,有的主族元素有多种正化合价。
答案:B
8.(2010·赣州市质检)下图是元素周期表的一部分。A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的3/5,则下列说法不正确的是( )
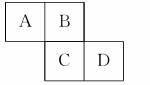
A.气态氢化物的稳定性:A>D
B.B元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:D>C
D.阴离子半径从大到小的排列顺序为:C>D>B
解析:根据C的最外层电子数是其内层电子数的3/5,可知C为S,从而可以确定A为N、B为O、D为Cl。气态氢化物的稳定性:HCl>NH3,A错;O元素有O2和O3两种同素异形体,常温下均为气体,B对;非金属性:Cl>S,因此最高价氧化物对应水化物的酸性:HClO4>H2SO4,C对;O2-核外有两个电子层,S2-、Cl-核外有三个电子层,离子半径大小为S2->Cl->O2-,D对。
答案:A
7.(2010·江西省联考)下列说法中错误的是( )
A.非金属元素的原子及其阴离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
解析:同一元素的各种同位素质量数不同,物理性质不同;最外层电子数相同,化学性质相同,D错。
答案:D
6.(2010·江西省联考)下列排列顺序正确的是( )
①稳定性:HF>H2O>NH3
②离子半径:Na+>Mg2+>F-
③酸性:盐酸>碳酸>醋酸
④结合质子能力:OH->C6H5O->HCO
A.①③ B.②④
C.①④ D.②③
解析:非金属性:F>O>N,因此氢化物稳定性:HF>H2O>NH3,①对;Na+、Mg2+、F-具有相同的电子层结构,根据具有相同电子层结构的粒子,核电荷数越大,粒子半径越小,因此离子半径:F->Na+>Mg2+,②错;酸性:盐酸>醋酸>碳酸,③错;由于酸性:H2CO3>苯酚>水,因此结合质子能力:OH->C6H5O->HCO,④对。
答案:C
5.(2010·四川省期末)下列叙述正确的是( )
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A.只有②⑦ B.只有①⑦
C.只有⑦ D.只有①⑤⑦
解析:H2O2、N2H4、C2H6等都含有非极性共价键,①错;过氧化钠中含有非极性键,它是离子化合物,③错;二氧化硅、碳化硅、氮化硅等都是原子晶体,也是共价化合物,它们的熔点高于离子晶体,④错;稀有气体原子既难失电子,又难得到电子,⑤错;除稀有气体外,氮气、氧气、氯气、S8等单质都含非极性共价键,⑥错。
答案:A
4.(2010·西安联考)短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是( )
A.D元素处于元素周期表中第3周期第ⅥA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
解析:根据信息可以推断A为氢,B为碳,C为钠,D为硅。硅处于元素周期表中第3周期第ⅣA族,A错。四种元素原子半径:Na>Si>C>H,B错。B、D的最高价氧化物分别为CO2、SiO2,CO2为分子晶体,熔沸点低;而SiO2为原子晶体,熔沸点高,C错。根据2C+SiO22CO↑+Si、2Na+2H2O===2NaOH+H2↑,D对。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com