
题目列表(包括答案和解析)
7.(2010·黄冈市质检)向盛有50 mL 1.00 mol·L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )
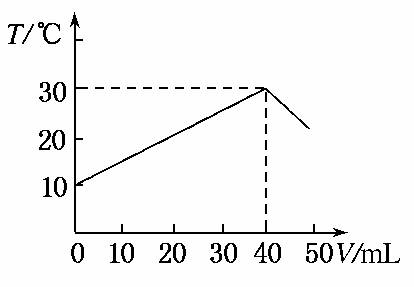
A.该实验表明化学能可以转化为热能
B.NaOH溶液的浓度大于1.00 mol/L
C.V=50 mL时,混合液的pH>7
D.该实验表明有水生成的反应都是放热反应
解析:A项,由图象可知,随着反应的进行,混合液的温度升高,故该反应是放热反应,即将化学能转变为热能,正确;B项,由图象可知,加入40 mL氢氧化钠溶液时恰好完全中和,则表明氢氧化钠溶液的浓度大于1 mol/L,正确;C项,V=50 mL时,氢氧化钠溶液过量,此时的pH大于7,正确;D项,不能由此反应说明有水生成的反应均为放热反应,如氢氧化钡与氯化铵的反应中也生成水,但却为吸热反应,故不正确。
答案:D
6.(2010·石家庄质检(二))反应CO(g)+2H2(g)CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
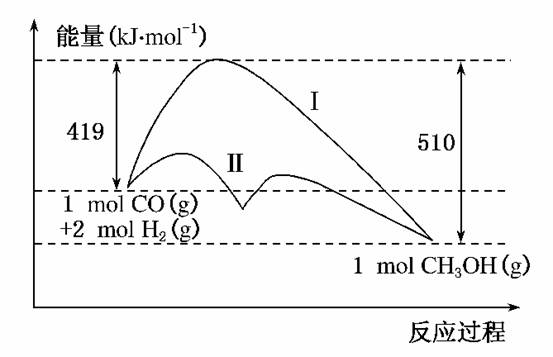
A.该反应的ΔH=+91 kJ/mol
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH变大
解析:根据图示,反应物的总能量大于生成物的总能量,该反应是放热反应,故选项A错误,C正确。选项B,加入催化剂只能降低反应所需的活化能,而对反应热无影响。选项D,生成液态CH3OH时释放出的热量更大,ΔH变小。
答案:C
5.(2010·成都市检测)已知:①CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1 ②H2(g)+O2(g)===H2O(g);ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
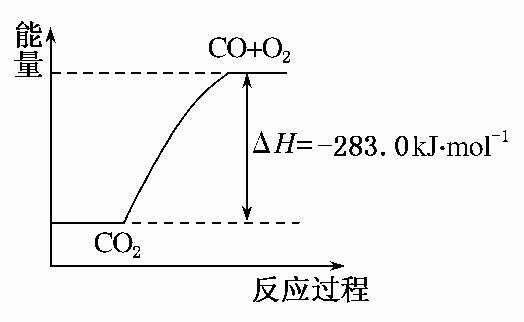
A.通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B.由①可知,1 mol CO(g)和mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量
C.可用上图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系
D.分解1 mol H2O(g),其反应热为-241.8 kJ
解析:选项A,热化学方程式②中,H2O(g)不是稳定态,所以241.8 kJ·mol-1不是H2的燃烧热。选项B,根据热化学方程式的含义可知正确。选项C,忽视化学计量数与反应热的关系,错误。选项D,分解1 mol H2O(g)吸收241.8 kJ热量,其反应热为+241.8 kJ/mol。
答案:B
4.(2010·邯郸市摸底考试)一些烷烃的燃烧热如下表:
|
化合物 |
燃烧热/kJ·mol-1 |
化合物 |
燃烧热/kJ·mol-1 |
|
甲烷 |
890.3 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
下列表达正确的是( )
A.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g);ΔH=-1560.8 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.正戊烷的燃烧热大于3531.3 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
解析:选项A,所给的热化学方程式中H2O为非稳定的气态,且ΔH值也与化学计量数不符,错误。选项B,等物质的量的正丁烷燃烧释放出的热量大于异丁烷,说明正丁烷具有的总能量大于异丁烷,能量越高越不稳定,所以异丁烷的稳定性大于正丁烷。选项C,根据正丁烷的燃烧热大于异丁烷,推知正戊烷的燃烧热大于2甲基丁烷的燃烧热,即正戊烷的燃烧热大于3531.5 kJ·mol-1。选项D,相同质量的烷烃,氢的质量分数越大,燃烧放出的热量越多。
答案:C
3.(2010·石家庄质检(一))已知在101 kPa下,1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ。则下列说法中正确的是( )
A.氢气的燃烧热为241.8 kJ·mol-1
B.1 mol H2O(l)具有的能量大于1 mol H2O(g)具有的能量
C.反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g);ΔH=+483.6 kJ·mol-1
D.2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量
解析:A项,燃烧热是指生成液态水时放出的热量,而题中给出的是气态水,故不能得出燃烧热的数据;B项,气态水所具有的能量大于液态水所具有的能量;C项,氢气燃烧时放热,ΔH的值应为负值;D项,放热反应中,反应物的总能量大于生成物的总能量,故正确。
答案:D
2.(2010·四川省检测)已知:①H+(aq)+OH-(aq)===H2O(l);ΔH1;②2SO2(g)+O2(g)2SO3(g);ΔH2。其他条件不变时,改变反应物的量,则下列判断正确的是( )
A.ΔH1增大,ΔH2减小 B.ΔH1增大,ΔH2增大
C.ΔH1减小,ΔH2减小 D.ΔH1不变,ΔH2不变
解析:ΔH1表示稀溶液中强酸与强碱反应生成1 mol水的反应热,与反应物的量无关;ΔH2表示2 mol二氧化硫气体与1 mol氧气完全反应生成2 mol三氧化硫气体的反应热,与反应物的量无关。
答案:D
1.(2010·北京市抽样)反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )
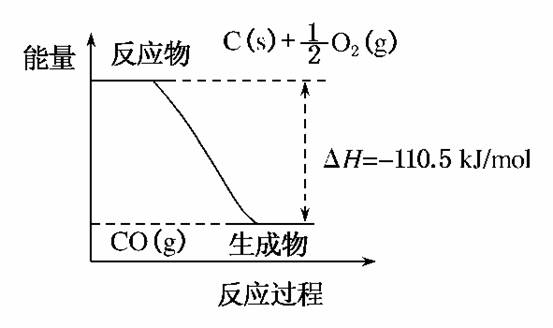
A.12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
C.该反应的热化学方程式是2C(s)+O2(g)===2CO(g);ΔH=-221 kJ
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
解析:根据图示,12 g C(s)与一定量O2(g)反应生成28 g CO(g)放出的热量为110.5 kJ,A错;2 mol C(s)与O2(g)反应生成CO(g)放出的热量为221 kJ,由于CO(g)与O2(g)反应生成CO2(g)放热,因此2 mol C(s)与足量O2(g)反应生成CO2(g)放出的热量大于221 kJ,B对;该反应的热化学方程式是2C(s)+O2(g)===2CO(g);ΔH=-221 kJ/mol,C错;该反应的反应热等于CO分子中化学键形成时所释放的总能量与C、O2分子中化学键断裂时所吸收的总能量的差,D错。
答案:B
16.(2009·长春实验中学模拟)C60、金刚石和石墨的结构模型如下图所示(石墨仅表示出其中的一层结构):
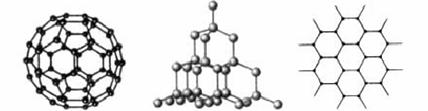
(1)C60、金刚石和石墨三者的关系是互为________(选填代号)。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”“原子”或“分子”),C60分子中含有双键的数目是________。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是________ NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________。
解析:(1)所给三种物质都是只由碳元素组成,故它们互为同素异形体。
(2)C60中只含碳元素,且不具有向空间无限伸展的网状结构,所以为分子晶体;C60的分子中形成的总的价电子数为60×4=240,由图示可知已成键的价电子数为60×3,所以可形成的双键数为:=30。
(3)由金刚石的结构模型可知,每个碳原子都与相邻的碳原子形成一个单键,故每个碳原子相当于形成(×4)个单键,则1 mol硅中可形成2 mol硅硅单键;金刚石中最小的碳原子环上有6个碳原子,6条边,每条边上插入一个氧原子,则最小环上有6个氧原子。
(4)石墨层状结构中每个碳原子为三个正六边形共有,即对每个六边形贡献个碳原子,所以每个正六边形环上有×6=2个碳原子。
答案:(1)B (2)分子 30 (3)2 6 (4)2
15.(2010·唐山市联考)甲、乙、丙、丁四种短周期元素的位置如图所示(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等。
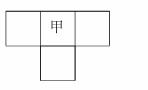
(1)甲元素在周期表中的位置为________。
(2)丙、丁可形成AB2型化合物,其电子式为________________。该分子是________________(填“极性分子”或“非极性分子”)。
(3)丙是自然界中形成化合物种类最多的元素,则丙是________(填名称),其单质与甲元素的最高价氧化物对应水化物的浓溶液共热时反应的化学方程式是____________________。
(4)若甲、乙、丙、丁四种元素两两化合时,丁与其他三种元素得到的化合物种类最多,则丁是________(填元素符号),写出这些化合物中任意两种符合以下条件的化学式________(①原子个数比为1?2;②分子中价电子总数为偶数)。
解析:设甲的原子序数为n,则(n-1)+n+(n+1)+(n+8)=36,解得n=7。故甲为N,则乙、丙、丁是C、O、P中的一种。由于乙的原子序数是甲与丁的原子序数之和,故乙为P,丁为O,则丙为C。(1)甲为N元素,处于元素周期表中的第二周期ⅤA族。(2)AB2即CO2,电子式为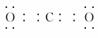 ,属于非极性分子。(3)在加热的条件下,碳与浓硝酸发生氧化还原反应,生成二氧化碳、二氧化氮和水。(4)O与C、N、P形成的原子个数比为1?2的化合物有CO2、NO2、N2O、N2O4,其中NO2的价电子总数为奇数,不符合题意。
,属于非极性分子。(3)在加热的条件下,碳与浓硝酸发生氧化还原反应,生成二氧化碳、二氧化氮和水。(4)O与C、N、P形成的原子个数比为1?2的化合物有CO2、NO2、N2O、N2O4,其中NO2的价电子总数为奇数,不符合题意。
答案:(1)第二周期ⅤA族
(2) 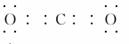 非极性分子
非极性分子
(3)碳
C+4HNO3(浓)CO2↑+4NO2↑+2H2O
(4)O CO2、N2O、N2O4
14.(2010·石家庄市质检(一))(1)请在下图所示元素周期表中用实线画出主族元素的边界。
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A。写出A的电子式____________________。
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式__________________________。
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是________(用离子符号表示),元素丁的原子序数比丙小8,写出元素丁的单质在CO2中燃烧的化学方程式________________________________________________________________________。
(5)元素戊是第三周期中简单离子半径最小的元素,写出该元素的最高价氧化物对应水化物的电离方程式__________________。
解析:(1)根据元素周期表中从左到右分别是ⅠA、ⅡA、ⅢB-ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA-ⅦA、0族的关系,其中Ⅷ族占三个纵行,可画出主族元素的边界。(2)元素甲是第三周期ⅦA族元素,则为Cl元素,与另两种非金属元素可形成离子化合物,则应该是与NH构成NH4Cl,其电子式为: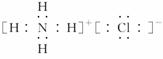 。(3)所有气态氢化物中最稳定的是HF,则元素F的单质与水反应的化学方程式为:2F2+2H2O===4HF+O2。(4)检验二氧化碳气体常用澄清石灰水,则金属元素丙为Ca,它的离子半径与Cl-半径比较时,根据相同电子层结构的离子,原子序数越大,离子半径越小,则为r(Ca2+)<r(Cl-);元素丁的原子序数比丙小8,则为Mg元素,它的单质在二氧化碳中燃烧的化学方程式为:2Mg+CO22MgO+C。(5)戊是第三周期中简单离子半径最小的元素,则为Al元素,它的最高价氧化物对应的水化物是Al(OH)3,它存在酸式电离和碱式电离,则电离方程式为:Al3++3OH-
。(3)所有气态氢化物中最稳定的是HF,则元素F的单质与水反应的化学方程式为:2F2+2H2O===4HF+O2。(4)检验二氧化碳气体常用澄清石灰水,则金属元素丙为Ca,它的离子半径与Cl-半径比较时,根据相同电子层结构的离子,原子序数越大,离子半径越小,则为r(Ca2+)<r(Cl-);元素丁的原子序数比丙小8,则为Mg元素,它的单质在二氧化碳中燃烧的化学方程式为:2Mg+CO22MgO+C。(5)戊是第三周期中简单离子半径最小的元素,则为Al元素,它的最高价氧化物对应的水化物是Al(OH)3,它存在酸式电离和碱式电离,则电离方程式为:Al3++3OH- Al(OH)3
Al(OH)3 AlO+H2O+H+。
AlO+H2O+H+。
答案:(1) 
(2) 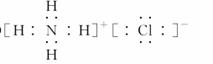
(3)2F2+2H2O===4HF+O2
(4)r(Ca2+)<r(Cl-)
2Mg+CO22MgO+C
(5)Al3++3OH- Al(OH)3
Al(OH)3 AlO+H2O+H+
AlO+H2O+H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com