
题目列表(包括答案和解析)
12.(2010·邯郸高三摸底考试)某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-):Na+、NH、SO、CO、NO。取200 mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33 g。下列说法正确的是( )
A.该溶液中可能含有Na+
B.该溶液中肯定含有NH、SO、CO、NO
C.该溶液中一定不含NO
D.该溶液中一定含有Na+,且c(Na+)≥0.1 mol·L-1
解析:根据实验1可知原溶液中含有0.01 mol NH;根据实验2可知,原溶液中不存在CO,但含有0.01 mol SO;无法确定原溶液中是否含有NO。根据电荷守恒关系可知原溶液中一定含有Na+,则有:c(Na+)+c(NH)=2c(SO)+c(NO),c(Na+)=0.2 mol·L-1-0.1 mol·L-1+c(NO);若原溶液中不存在NO,则c(Na+)=0.1 mol·L-1;若原溶液中存在NO,则c(Na+)>0.1 mol·L-1。综合上述,选项D正确。
答案:D
11.(2010·武汉市武昌区调研)类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是( )
|
|
已知 |
类推 |
|
A |
将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ |
将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
|
B |
稀硫酸与Ba(OH)2溶液反应至中性2H++SO+Ba2++2OH-===BaSO4↓+2H2O |
NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO+Ba2++2OH-===BaSO4↓+2H2O |
|
C |
铁和氯气反应2Fe+3Cl22FeCl3 |
铁和碘单质反应2Fe+3I22FeI3 |
|
D |
向Ca(ClO)2溶液中通入少量CO2
Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO |
向Ca(ClO)2溶液中通入少量SO2
Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
解析:钠加入到CuSO4溶液中,钠先与水反应生成NaOH和H2,随后NaOH与CuSO4反应生成Cu(OH)2和Na2SO4,A错;NaHSO4溶于水电离出Na+、H+和SO,与Ba(OH)2溶液反应至中性时的离子方程式为:2H++SO+Ba2++2OH-===BaSO4↓+2H2O,B对;碘的氧化性较弱,与铁反应时生成FeI2,C错;向Ca(ClO)2溶液中通入少量SO2发生氧化还原反应,离子方程式为:Ca2++2ClO-+SO2+H2O===CaSO4↓+H++Cl-+HClO,D错。
答案:B
10.(2009·大连模拟)下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
|
编号 |
化学反应 |
离子方程式 |
评价 |
|
A |
碳酸钙与 醋酸反应 |
CO+2CH3COOH ===CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
|
B |
苯酚钠溶液中通入少量CO2 |
C6H5O-+CO2+H2O―→C6H5OH+HCO |
错误,通入少量CO2应生成CO |
|
C |
NaHCO3的水解 |
HCO+H2OCO +H3O+ |
正确 |
|
D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl- |
正确 |
解析:A项中CaCO3是难溶的强电解质,不是弱电解质;B项通入的CO2无论多少都生成HCO;C项中的离子方程式不是HCO的水解方程式,而是电离方程式;D项,在等物质的量的情况下Fe2+完全反应,Br-部分反应。
答案:D
9.(2010·四川省高三检测)下列离子方程式不正确的是( )
A.在30 mL 1 mol/L Na2SO3溶液中通入标准状况下的Cl2 224 mL:H2O+SO+Cl2===SO+2Cl-+2H+
B.硝酸银溶液中滴加过量氨水:Ag++2NH3·H2O===[Ag(NH3)2]++2H2O
C.饱和碳酸钠溶液中通入二氧化碳后溶液变浑浊:
D.碳酸氢镁溶液中加入足量的澄清石灰水: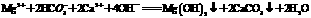
解析:n(Na2SO3)=0.03 mol,n(Cl2)=0.01 mol,SO+Cl2+H2O===SO+2H++2Cl-,SO+H+===HSO,0.01 mol Cl2只氧化0.01 mol SO,且生成0.02 mol H+,而0.02 mol H+与剩余的0.02 mol SO恰好完全反应生成0.02 mol HSO,离子方程式应为:3SO+Cl2+H2O===SO+2Cl-+2HSO。
答案:A
8.(2010·江西省联考)下列用来表示物质变化的离子方程式中,正确的是( )
A.明矾加入到氢氧化钡溶液中使硫酸根离子完全沉淀:
Al3++SO+Ba2++4OH-===AlO+BaSO4↓+2H2O
B.过量的二氧化硫通入到澄清石灰水中:SO2+OH-===HSO
C.向磷酸氢二钠溶液中加入过量澄清石灰水:2H2PO+3Ca2++4OH-===2Ca3(PO4)2↓+4H2O
D.常温下,NaHCO3溶液显碱性:HCO+H2OCO+H3O+
解析:A项中离子方程式应为:Al3++2SO+2Ba2++4OH-===AlO+2BaSO4↓+2H2O;C项中磷酸氢二钠应为Na2HPO4;D项中离子方程式应为:HCO+H2OH2CO3+OH-。
答案:B
7.(2010·江西省联考)下列反应的离子方程式正确的是( )
A.碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++H2O+CO2↑
B.硫酸铝溶液中加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH
C.向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO===BaCO3↓+CO+2H2O
解析:A项中醋酸为弱电解质,应写化学式,应为:CaCO3+2CH3COOH===Ca2++2CH3COO-+H2O+CO2↑;C项中还原性:Fe2+强于Br-,通入少量Cl2只有Fe2+被氧化,应为:2Fe2++Cl2===2Fe3++2Cl-;D项中氢氧化钡足量时,应为:Ba2++OH-+HCO===BaCO3↓+H2O。
答案:B
6.(2010·江西省联考)下列各种溶液中,能大量共存的离子组是( )
A.pH=0的溶液中:Fe2+、NO、SO、I-
B.c(H+)=10-14mol·L-1的溶液中:Na+、AlO、S2-、SO
C.酸性环境下的无色透明溶液中:Na+、Cu2+、NO、SO
D.含有0.1 mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO
解析:pH=0的溶液为强酸性溶液,酸性溶液中Fe2+、I-和NO发生氧化还原反应不能大量共存,A错;c(H+)=10-14mol/L的溶液为强碱性溶液,提供的四种离子均能大量共存,B对;Cu2+为蓝色,在无色溶液中不能大量存在,C错;Fe3+与I-发生氧化还原反应:2Fe3++2I-===2Fe2++I2,不能大量共存,D错。
答案:B
5.(2010·赣州市质检)某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是( )
A.Na+、Mg2+、S2-、ClO- B.H+、Na+、SO、NO
C.K+、Ca2+、OH-、SO D.Na+、K+、Cl-、OH-
解析:根据溴的化学性质,能使溴水褪色,则可能为碱性溶液或还原性溶液;根据NH4HCO3的化学性质,只有碱性溶液能与之反应产生刺激性气味的气体。因此该溶液为碱性溶液。A项中Mg2+在碱性溶液中不能大量共存;B项中H+在碱性溶液中不能大量共存;C项中虽然为碱性溶液,但Ca2+和SO不能大量共存。
答案:D
4.(2010·襄樊市调研)下列各溶液中一定能大量共存的离子组是( )
A.加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO、K+
B.使pH试纸呈红色的溶液中:Fe2+、I-、NO、Cl-
C.常温下,c(H+)=10-14mol/L的溶液中:Na+、AlO、S2-、SO
D.常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO、Ca2+
解析:加入铝粉有氢气生成的溶液既可能为强酸性溶液也可能为强碱性溶液,而Mg2+、Cu2+不能在强碱性溶液中大量存在,A错;使pH试纸呈红色的溶液为酸性溶液,Fe2+、I-与NO不能大量共存,B错;常温下,c(H+)=10-14mol/L的溶液为强碱性溶液,Na+、AlO、S2-和SO能大量共存;常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中,水的电离受到抑制,可能为强酸性溶液也可能为强碱性溶液,HCO在强酸性和强碱性溶液中均不能大量存在,D错。
答案:C
3.(2010·唐山市2月联考)Fe3+、SO、Mg2+和X四种离子以物质的量之比1:2:1:1大量共存于同一溶液中,X可能是( )
A.NH B.OH-
C.CO D.Cl-
解析:由于Fe3+、Mg2+的存在,可先排除选项B、C中的离子;设X所带的电荷为x,则根据溶液呈电中性原则可得关系式:3×1-2×2+2×1+x×1=0,解得x=-1,故只有选项D中的Cl-符合题意。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com