
题目列表(包括答案和解析)
(2)当导管口不再有气泡冒出时,为了防止倒吸应先把导气管移出水面,然后再熄灭酒精灯。
(3)Cu(NO3)2分解生成NO2、CuO,根据电子得失守恒和质量守恒知,分解产物中还应该有O2。
(1)反应中最先起氧化作用的是________。
(2)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
|
实验操作步骤 |
预期现象与结论 |
|
步骤1:观察样品 |
溶液呈蓝绿色,________(填“能”或“不能”)确定产物中铁元素的价态 |
|
步骤2:取少量溶液,滴加酸性KMnO4溶液 |
|
|
步骤3:________ |
若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
解析:(一)(1)由反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O与3CuO+6HNO3(稀)===3Cu(NO3)2+6H2O相比,生成等物质的量的Cu(NO3)2前者消耗HNO3多,而且生成的NO污染空气。
(2)固体的灼烧应放在坩埚中进行;从溶液中得到硝酸铜晶体应先蒸发浓缩再冷却结晶,最后过滤。
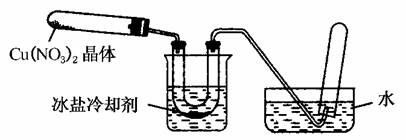
往左试管中放入研细的无水Cu(NO3)2晶体并加热,观察到左试管中有红棕色气体生成,最终残留黑色粉末;用U形管除去红棕色气体,在右试管中收集到无色气体。
(1)红棕色气体是________。
(2)当导管口不再有气泡冒出时,停止反应,这时在操作上应注意________________________________________。
(3)探究小组判断Cu(NO3)2的分解属于氧化还原反应,产物除了红棕色气体和黑色固体外,进一步分析、推断,分解产物中一定还含有________。
(1)如果直接用铜屑与稀HNO3反应来制取硝酸铜,可能导致的两个不利因素是________、________。
(2)实验中铜粉应该放在________(填“蒸发皿”、“坩埚”或“烧杯”)中灼烧。欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序分别是________、________、过滤。
16.(2010·江西省高三联考)硝酸铜受热易分解:2Cu(NO3)2 △ 2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO 高温 2Cu2O+O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2===N2O4,2NO2=2NO+O2等反应)。现取5.64 g Cu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
(1)若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是________。
(2)若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况下)是________。
(3)若该质量的无水硝酸铜分解后的残留固体中含有1.60 g CuO,则残留固体的质量可能是________。
(4)设该质量的无水硝酸铜在分解过程中,得到的残留固体质量为x,生成的气体中NO2和O2的体积比为y,求y与x的关系式:________;________。
解析:(1)由题意可知n[Cu(NO3)2]=0.03
mol,根据铜元素守恒可得n(CuO)=0.03 mol,m(CuO)=2.4 g。(2)无水硝酸铜分解生成CuO时,生成的NO2与O2恰好与水完全反应,多余的气体为CuO分解生成的氧气,4CuO~O2,n(O2)=0.03/4=0.0075(mol),标准状况下的体积为0.168 L。(3)残留固体可能是CuO和Cu2O的混合物,也可能是CuO和Cu(NO3)2的混合物。若为CuO和Cu2O的混合物,则n(CuO)=0.02 mol, n(CuO)+2n(Cu2O)=0.03
mol, n(Cu2O)=0.005 mol, m(Cu2O)=0.72g, m(残留固体)=1.60 g+0.72 g=2.32 g; 若为CuO和Cu(NO3)2的混合物,则n(CuO)=0.02 mol, 则n(CuO)+n[Cu(NO3)2]=0.03
mol, n[Cu(NO3)2]=0.01 mol,m[Cu(NO3)2]=1.88
g,m(残留固体)=1.60 g+1.88 g=3.48 g。(4)当残留固体为CuO和Cu(NO3)2的混合物或全部为CuO时,只发生反应:2Cu(NO3)2
△ 2CuO+4NO2↑+O2↑,此时,NO2和O2的体积比为y=4,2.4 g≤x<5.64 g;当残留固体为CuO和Cu2O的混合物或全部为Cu2O时,设CuO的物质的量为m mol, Cu2O的物质的量为n mol,则n(CuO)+2n(Cu2O)=m+2n=0.03(mol),x=80m+144n,y=0.06/(0.015+0.5n),解得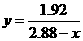 ,此时2.16g≤x<2.4g;另外,x=2.4 g时也符合
,此时2.16g≤x<2.4g;另外,x=2.4 g时也符合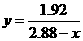 。
。
答案:(1)2.4 g (2)O2 0.168 L (3)3.48 g或2.32 g (4)2.4g≤x<5.64 g,y=4 2.16 g≤x≤2.4 g,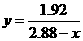
15.(2010·赣州质检)80℃,101 kPa下,用下图装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH3、O2、N2、H2S、NO、CO2等气体,B筒内装有Na2O2固体,推动A的活塞,A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化。(不考虑2NO2===N2O4)
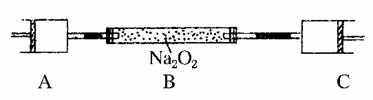
(1)C中发生反应的化学方程式是________________。已知原C中的气体是单一气体,它是________,理由是______________________________________________。
(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前C中的气体是________,理由是__________________________
__________________________ 。
(3)若实验开始前A、C中气体体积(换算成标况)分别为1.40 L和2.24 L,且A中的气体经过B管后,B管增重了1.40 g。经计算和推理可判定A中的气体是________,其质量为________g。(不必写出计算和推理过程)
解析:(1)C中气体由无色变为红棕色,则发生了NO和O2转化为NO2的反应。(2)运用极限法,分别假设全部为NO或NO2,可以计算出与水反应后气体的体积变化,从而确定出C中气体为NO和NO2。(3)根据Na2O2与CO2的反应,B管增重的质量为与CO2等物质的量的CO的质量,因此n(CO2)=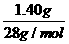 =0.05 mol,而C筒中气体体积无变化,则A中另一种气体为O2,n(O2)=
=0.05 mol,而C筒中气体体积无变化,则A中另一种气体为O2,n(O2)=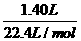 -0.05 mol=0.0125 mol,故A中气体的质量为:0.05 mol×44 g/mol+0.0125 mol×32 g/mol=2.6 g。
-0.05 mol=0.0125 mol,故A中气体的质量为:0.05 mol×44 g/mol+0.0125 mol×32 g/mol=2.6 g。
答案:(1)2NO+O2=2NO2 NO NO与B管进来的O2反应生成NO2的体积与原NO体积相同,只发生了颜色变化
(2)NO2和NO 若C管中只有NO2,则剩余气体的体积为原来的1/3,若只有NO,则剩余气体的体积与原来相等,因而只能是NO2与NO的混合气体(3:1)
(3)CO2和O2 2.6
14.如图所示的实验装置可用来测定含两种元素的某种气体X的化学式。
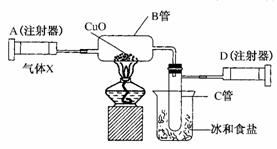
在注射器A中装有240 mL气体X,慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:
实验前B管总重20.32 g,实验后B管总重20.00 g,B管中的黑色粉末变成红色粉末。
在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24000 mL,则X的摩尔质量是________g/mol。
(3)通过计算,确定X的化学式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)__________________________。
解析:在C管中收集到水,则X中一定含有氢元素;在D中收集到N2,说明X中一定含有N元素,即X中含N、H两种元素。
B管中CuO含O:20.32 g-20.00 g=0.32 g,
n(O)= =0.02 mol,n(N2)=
=0.02 mol,n(N2)= =0.01 mol,
=0.01 mol,
本实验条件下Vm=24 L/mol,所以n(X)=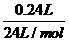 =0.01 mol,因此n(X):n(N):n(H)=0.01 mol:(0.01
mol×2):(0.02 mol×2)=1:2:4,所以X的化学式为N2H4,摩尔质量为32 g/mol。
=0.01 mol,因此n(X):n(N):n(H)=0.01 mol:(0.01
mol×2):(0.02 mol×2)=1:2:4,所以X的化学式为N2H4,摩尔质量为32 g/mol。
答案:(1)N H (2)32 (3)N2H4
(4)N2H4+2CuO △ N2+2H2O+2Cu
13.(2010·赣州市质检)一定条件下,4 g A和14 g B的混合气体体积为448 mL,相同状况下,8 g A和17 g B的混合气体体积为672 mL,A、B可能是下列各组中的( )
A.乙烯和乙炔 B.乙炔和苯
C.甲烷和甲醇 D.环己烷和1?丁烯
解析:设A、B的摩尔质量分别为x g/mol、y g/mol。由于在相同状况下,两组混合气体的体积比等于物质的量之比,则有(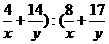 )=448:672,解得:x:y=1:2,只有C项符合。
)=448:672,解得:x:y=1:2,只有C项符合。
答案:C
12.(2010·四川省摸底考试)现有6 g含有杂质的亚硫酸钠固体,与足量的盐酸反应产生标况下1.12 L气体,并测得该气体的相对分子质量为60,则固体中所含的杂质可能是( )
A.Na2CO3 B.NaHCO3
C.Na2CO3和NaHCO3 D.Na2SO4
解析:气体相对分子质量为60,说明气体为二氧化硫和二氧化碳的混合气体。由十字交叉法得
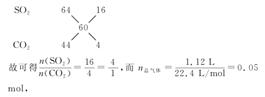
故可得n(SO2)=0.04 mol,n(CO2)=0.01 mol。
若杂质为Na2CO3,则m(Na2CO3)=0.01×106=1.06(g),
m(Na2SO3)=5.04 g,
故m总=1.06 g+5.04 g=6.1 g>6 g,不符合题意;
若杂质为NaHCO3,m(NaHCO3)=0.01×84=0.84(g),则m总=0.84 g+5.04 g=5.88 g<6 g,不符合题意;
根据平均值原理知,答案为C。
答案:C
11.(2010·黄冈市质检)某同学用NaHCO3和KHCO3组成的混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如下表:
|
盐酸/mL |
50 |
50 |
50 |
|
混合物质量/g |
9.2 |
15.7 |
27.6 |
|
标准状况下CO2体积/L |
2.24 |
3.36 |
3.36 |
下列分析推理不正确的是( )
A.盐酸的物质的量浓度为3.0 mol/L
B.根据表中数据能计算混合物中NaHCO3的质量分数
C.加入9.2 g混合物时盐酸过量
D.15.7 g混合物恰好与盐酸完全反应
解析:A项,由表中数据可知,求盐酸浓度需选择盐酸不足量的数据进行,如随着混合物质量增加,二氧化碳气体量不再增加,表明盐酸全部反应完,H++HCO-3=H2O+CO2↑,c(HCl)=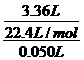 =3 .0 mol/L,正确;B项,根据表中第一栏数据固体混合物的总质量及产生标准状况下的二氧化碳气体的体积可以计算出NaHCO3的质量分数,正确;C项,由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故盐酸过量,正确;D项,根据固体混合物与气体的比例关系可知,产生3.36 L二氧化碳所需固体质量为:
=3 .0 mol/L,正确;B项,根据表中第一栏数据固体混合物的总质量及产生标准状况下的二氧化碳气体的体积可以计算出NaHCO3的质量分数,正确;C项,由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故盐酸过量,正确;D项,根据固体混合物与气体的比例关系可知,产生3.36 L二氧化碳所需固体质量为: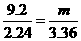 ,解得m=13.8 g,此时盐酸恰好完全反应,故不正确。
,解得m=13.8 g,此时盐酸恰好完全反应,故不正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com