
题目列表(包括答案和解析)
7.(2010·邯郸市摸底考试)将过量的气体通入到一种溶液中,一定能产生沉淀的是( )
①二氧化硫通入到硝酸钡溶液中 ②二氧化碳通入到偏铝酸钠溶液中 ③二氧化碳通入到氯化钙溶液中 ④氨气通入到AgNO3溶液中
A.只有①②③ B.只有①②
C.只有①②④ D.只有②③
解析:①:SO2被HNO3氧化为SO从而产生BaSO4沉淀;②:CO2与NaAlO2溶液反应生成Al(OH)3沉淀,Al(OH)3在H2CO3中不溶解,无论CO2量的多少,最终都会有Al(OH)3沉淀产生;③:不符合复分解反应发生的条件,不发生反应;④:氨气过量生成银氨溶液而不产生沉淀。
答案:B
6.(2010·石家庄质检(一))实验室常用下列三个反应制备Cl2:
①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
②2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O;
③KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。
如果分别用上述方法制得等量的Cl2,下列说法中正确的是( )
A.参加反应的HCl的物质的量相等
B.转移电子的总数相等
C.消耗氧化剂的物质的量相等
D.被氧化的氯离子数不相等
解析:A项,参加反应的HCl的物质的量不相等,三者关系应该为10?:8?:5,不正确;B项,由于反应①②中Cl元素的化合价均是从-1升高到0,两者转移电子总数相等,而③中Cl元素的化合价从+5到0和-1到0,故转移电子数与反应①②不相等;C项,由反应方程式可知消耗的氧化剂的物质的量不相等;D项,正确。
答案:D
5.(2010·赣州市质检)某气体能使石蕊试液变红,能使酸性高锰酸钾溶液褪色,若通入溴水中,可使溶液变浑浊。该气体是( )
A.CO2 B.Cl2 C.H2S D.SO2
解析:该气体能使石蕊试液变红,则其溶液显酸性;能使酸性高锰酸钾溶液褪色,则具有还原性。满足这两点的只有H2S和SO2,但SO2与溴水反应无沉淀产生。
答案:C
4.(2010·江西省联考)2009年10月6日,诺贝尔物理学奖授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德·博伊尔和乔治·史密斯。光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )
A.二氧化硅是H2SiO3的酸酐,因此能与水反应
B.用二氧化硅制取单质硅时,当生成2.24 L气体(状况)时,得到2.8 g硅
C.6 g的二氧化硅中含有0.2 mol的共价键
D.二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应
解析:A项中二氧化硅不能与水反应;B项中用二氧化硅制取单质硅,当生成2.24 L气体(标况)时,只能得到1.4 g硅;C项中6 g的二氧化硅中含有0.4 mol的共价键。
答案:D
3.(2010·江西省联考)据英国《泰晤士报》报道,2009年1月20日,以色列军方首次“承认”在加沙冲突中使用了违禁武器白磷弹。下列关于白磷的说法正确的是( )
A.红磷与白磷互称为同位素
B.白磷很容易发生自燃,故实验室将白磷放在二硫化碳中保存
C.白磷分子是正四面体构型,由非极性键组成的非极性分子
D.3.1 g白磷中含有0.6 NA个P-P键
解析:A项中红磷与白磷互称为同素异形体;B项中白磷放在冷水中保存;D项中3.1 g白磷是0.025 mol,含有0.15 NA个P-P键。故A、B、D错误,即选C。
答案:C
2.(2010·江西省联考)某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列防护措施合理的是( )
①及时向上风口和地势较高处转移疏散人群;②及时戴上用浓烧碱溶液湿润过的口罩;③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;④及时戴上用稀纯碱溶液湿润过的口罩;⑤及时用毛巾包裹活性炭捂住口鼻;⑥就近向地下商场转移。
A.②③④⑤ B.①③④⑤
C.①②④⑤ D.①③④⑥
解析:②中浓烧碱溶液有腐蚀性,对人体有害;⑥中因氯气密度比空气大,故不能向低处转移。故选B。
答案:B
1.(2010·唐山市模拟)2009年联合国气候大会上,各国达成采用低碳经济的共识,下列叙述不正确的是( )
A.CO2是只含极性键的非极性分子,容易产生温室效应
B.大力植树造林,提高森林覆盖率,可大幅度降低大气中的CO2含量
C.CO2的比例模型为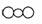
D.CO2与SiO2的物理性质差异明显,主要原因是它们的晶体类型不同
解析:碳原子半径比氧原子半径大,C项的比例模型中原子的大小比例不正确。
答案:C
15.(2010·江西省联考)现有由等质量的NaHCO3和KHCO3组成的混合物a g与100 mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可用带字母的式子表示,可不化简)
(1)该混合物中NaHCO3和KHCO3的物质的量之比为________。
(2)如果碳酸氢盐与盐酸恰好完全反应,则盐酸中的HCl的物质的量为________mol。
(3)如果盐酸过量,生成CO2的体积是________L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道__________________。
解析:(1)该混合物中NaHCO3和KHCO3的物质的量之比为?:=100:?84=25?:21。(2)如果碳酸氢盐与盐酸恰好完全反应,根据反应的化学方程式,则n(HCl)=n(NaHCO3)+n(KHCO3)=(+)mol。(3)如果盐酸过量,则n(CO2)=n(NaHCO3)+n(KHCO3),故V(CO2)=(+)×22.4 L。(4)如果反应后碳酸氢盐剩余,则n(CO2)=n(HCl),要计算CO2的体积,还需要知道盐酸的物质的量浓度。
答案:(1)100?:84(或25?:21)
(2)a/168+a/200(或23a/2100)
(3)22.4×(a/168+a/200)(或22.4×23a/2100)
(4)盐酸的物质的量浓度
14.(2010·北京市东城区检测)铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为__________________________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是______________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是__________________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是____________________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
陈述Ⅲ |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁得到铁 |
Ⅰ对;Ⅱ对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
Ⅰ错;Ⅱ对;无 |
|
D |
在空气中铁的表面能形成致密的氧化膜 |
铁不能与氧气反应 |
Ⅰ对;Ⅱ对;有 |
解析:(4)1 mol Fe3O4参与反应时,需4 mol CO,根据4 mol CO可得转移8 mol电子,所以1.5 mol Fe3O4参加反应时转移电子的物质的量为1.5×8 mol=12 mol。(5)选项A,地壳中含量最高的金属元素是Al元素,而不是Fe元素,由于铁是活泼金属,需通过冶炼方法获得,所以Fe不是人类最早使用的金属材料,陈述Ⅰ、Ⅱ错误,且二者没有因果关系。选项B,Fe能与稀H2SO4发生置换反应而产生H2,但在高温条件下,H2还原性很强,又能还原Fe2O3而得Fe,所以Ⅰ、Ⅱ均正确,二者无因果关系。选项C,铁是过渡元素的说法正确。选项D,铁在空气中不能形成致密的氧化膜,且Fe可与纯净的O2反应生成Fe3O4。
答案:(1)O2+2H2O+4e-===4OH-
(2)2Fe3++Cu===2Fe2++Cu2+
(3)Fe3++3H2OFe(OH)3(胶体)+3H+ 酸性环境中,H+抑制了铁离子的水解,无法生成氢氧化铁胶体
(4)12 mol (5)B
13.(2010·四川省“一诊”考试)下图是浓硫酸与金属铜反应的实验装置。请回答下列问题:
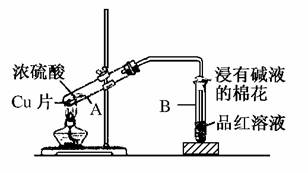
(1)在进行实验前必须要进行的一步操作是________________。
(2)试管B的口部放有一团浸有碱液的棉花,其目的是
________________________________________________________________________
________________________________________________________________________。
(3)能说明产物中有SO2生成的现象是________________________________________________________________________。
(4)铜与浓硫酸反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(5)反应结束后,试管A中铜片和硫酸均有剩余,待试管冷却后某同学向其中直接加入Ba(NO3)2溶液,则可能产生的现象是________________________,有关反应的离子方程式为____________________________。
答案:(1)检查装置的气密性 (2)吸收SO2,防止污染环境 (3)B中品红溶液褪色 (4)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (5)产生无色气体和白色沉淀 Ba2++SO===BaSO4↓,3Cu+8H++2NO===3Cu2++2NO↑+4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com