
题目列表(包括答案和解析)
2.下列说法中正确的是 ( )
A.氯化钠水溶液在电流的作用下电离出Na+和Cl-
B.硫酸钡难溶于水,但硫酸钡属于强电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
D.硫酸钠在水中的电离方程式可表示为Na2SO4===2Na++S6++4O2-
1.下列状态的物质,既能导电又属于电解质的是 ( )
A.MgCl2晶体 B.NaCl溶液
C.液态HCl D.熔融的KOH
16.(1)
|
排除的离子 |
排除的依据 |
|
NH Ag+、Mg2+ |
由于溶液呈碱性,且未嗅到刺激性气味 碱性溶液中无沉淀生成 |
(2)
|
肯定存在的离子 |
判断依据 |
|
AlO CO |
加酸有沉淀,继续加酸沉淀溶解 加酸后有无色无味气体逸出 |
|
排除的离子 |
排除的依据 |
|
Ba2+ SO |
有CO存在时原溶液无沉淀 酸化后逸出的气体没有刺激性气味 |
(3)
|
尚待检验的离子 |
检验方法 |
|
Na+、K+、SO |
通过焰色反应可检验Na+、K+是否存在,SO可用盐酸酸化的BaCl2溶液检验 |
15.(1)Al3+、Mg2+、SO Cu2+、NH、Fe3+、CO Na+、K+、NO (2)Al2(SO4)3、MgSO4
14.(1)K+、OH-、AlO、CO NH、Al3+、SiO (2)含有 (3)OH-+H+===H2O,AlO+H++H2O===Al(OH)3↓,CO+2H+===CO2↑+H2O,Al(OH)3+3H+===Al3++3H2O,Ag++Cl-===AgCl↓
13.(1)Fe3+、Mg2+、CO、Ba2+ Cl-
(2)SO 0.5 mol/L NH 0.2 mol/L Al3+ 0.2 mol/L
(3)是 溶液中肯定存在的离子是NH、Al3+、SO。经计算,NH、Al3+物质的量都是0.02 mol,SO物质的量是0.05 mol。根据电荷守恒,K+一定存在
11.A 12.B
16.(13分)有一白色固体混合物,可能含有的阴、阳离子分别是
|
阳离子 |
K+ Ba2+ Ag+ Mg2+ NH Na+ |
|
阴离子 |
SO SO CO AlO |
为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列表格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。
|
排除的离子 |
排除的依据 |
|
|
|
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。
|
肯定存在的离子 |
判断依据 |
|
|
|
|
排除的离子 |
排除的依据 |
|
|
|
(3)尚待检验的离子及其检验方法
|
尚待检验的离子 |
检验方法 |
|
|
|
答案 1.D 2.A 3.D 4.D 5.A 6.C 7.A 8.A 9.C 10.B
15.(8分)有一无色透明溶液,可能含Cu2+、NH、Al3+、Fe3+、Mg2+、Na+、K+、CO、SO、NO等离子中的若干种。现做如下实验:
①取少量该溶液,滴入用盐酸酸化的BaCl2溶液,有白色沉淀生成。
②另取部分溶液,加入过氧化钠,有无色气体放出,且有白色沉淀产生,加入过氧化钠的量与生成白色沉淀的量可用下图表示。
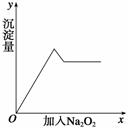
试推断:
(1)该溶液中一定存在______,一定不存在________,可能存在____________。
(2)上述溶液中至少有______________________等物质混合而成。
14.(8分)某强碱性溶液中含有的离子是K+、NH、Al3+、AlO、CO、SiO、Cl-中的某几种,进行如下实验:
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;②另取少量溶液,加入盐酸其发生的现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
试回答下列问题:
(1)原溶液中肯定存在的是________,肯定不存在的是__________________________。
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?
(3)请写出此题中肯定发生的离子方程式:_________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com