
题目列表(包括答案和解析)
12.下列推论正确的是 ( )
A.S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b
B.C(石墨,s)===C(金刚石,s) ΔH=1.9 kJ/mol,则可判定金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的溶液与稀盐酸完全反应,放出的热量为28.7 kJ
D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行
11.在一定条件下,当64 g SO2气体被氧化成SO3气体时,共放出热量98.3 kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是 ( )
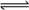 A.SO2(g)+O2(g)SO3(g) ΔH=-98.3
kJ/mol
A.SO2(g)+O2(g)SO3(g) ΔH=-98.3
kJ/mol
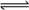
 B.2SO2(g)+O2(g)SO3(l) ΔH=-196.6
kJ/mol
B.2SO2(g)+O2(g)SO3(l) ΔH=-196.6
kJ/mol
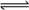
 C.SO2(g)+O2(g)SO3(g) ΔH=-122.9
kJ/mol
C.SO2(g)+O2(g)SO3(g) ΔH=-122.9
kJ/mol
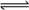
 D.2SO2(g)+O2(g)SO3(g) ΔH=196.6 kJ/mol
D.2SO2(g)+O2(g)SO3(g) ΔH=196.6 kJ/mol
10.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH1
②Sn(s、灰)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH2
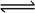 ③Sn(s、灰)>13.2℃<13.2℃Sn(s、白) ΔH3=2.1 kJ/mol,下列说法正确的是 ( )
③Sn(s、灰)>13.2℃<13.2℃Sn(s、白) ΔH3=2.1 kJ/mol,下列说法正确的是 ( )
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁灭
9.一定条件下,化学反应2H2+O2===2H2O的能量变化如图所示,则反应的热化学方程式可表示为( )
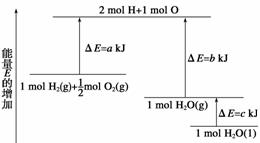
A.H2(g)+O2(g)===H2O(g) ΔH=(a+b) kJ/mol
B.2H2(g)+O2(g)===2H2O(g) ΔH=2(b-a) kJ/mol
C.H2(g)+O2(g)===H2O(l) ΔH=(b+c-a) kJ/mol
D.2H2(g)+O2(g)===2H2O(l) ΔH=2(a-b-c) kJ/mol
8.下列说法中正确的是 ( )
 A.SO2(g)+O2(g)
A.SO2(g)+O2(g) SO3(g) ΔH=-98.3 kJ/mol,当1
mol SO2(g)与 mol O2(g)完全转化为SO3时反应放出的热量为98.3 kJ
SO3(g) ΔH=-98.3 kJ/mol,当1
mol SO2(g)与 mol O2(g)完全转化为SO3时反应放出的热量为98.3 kJ
B.2SO2(g)+O2(g)  2SO3(g) ΔH1,则ΔH1>ΔH(ΔH数值由A项给出)
2SO3(g) ΔH1,则ΔH1>ΔH(ΔH数值由A项给出)
C.X(g)+Y(g)  Z(g)+W(s) ΔH>0,平衡后加入X,ΔH增大
Z(g)+W(s) ΔH>0,平衡后加入X,ΔH增大
D.X(g)+Y(g)  Z(g)+W(s) ΔH>0,平衡后加入少量Z,放出的热量增加
Z(g)+W(s) ΔH>0,平衡后加入少量Z,放出的热量增加
7.(2009·海南,12)已知:
(1)Fe2O3(s) +C(s)===CO2(g)+2Fe(s) ΔH=234.1 kJ/mol
(2)C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+O2(g)===Fe2O3(s) 的ΔH是 ( )
A.-824.4 kJ/mol B.-627.6 kJ/mol
C.-744.7 kJ/mol D.-169.4 kJ/mol
6.已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH1=-176 kJ/mol
②NH3(g)NH3(aq) ΔH2=-35.1 kJ/mol
③HCl(g)HCl(aq) ΔH3=-72.3 kJ/mol
④NH3(aq)+HCl(aq)===NH4Cl(aq) ΔH4=-52.3 kJ/mol
则NH4Cl(s)NH4Cl(aq)的反应热ΔH5(kJ/mol)为 ( )
A.16.3 B.-16.3 C.335.7 D.-335.7
5.已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况),经充分燃烧后,放出的总热量为710.0 kJ,并生成液态水。下列说法正确的是 ( )
A.CO燃烧的热化学方程式为:2CO(g)+O2(g)===2CO2(g) ΔH=282.8 kJ/mol
B.H2燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ/mol
C.燃烧前混合气体中,H2的体积分数为40%
D.燃烧后的混合气体与足量的过氧化钠反应,转移电子的物质的量为2 mol
4.已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量,下列叙述正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是:
H2(g)+Cl2(g)===2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=183 kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=183 kJ/mol
3.(2009·上海理综,10)右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是 ( )

A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com