
题目列表(包括答案和解析)
12.中学所学的A、B、C三种物质都是由H、O、S、Na中的三种元素组成的强电解质,A、B的水溶液均呈碱性,测得pH相等的A、B溶液c(A)<c(B);C的水溶液呈酸性。有关说法正确的是( )
A.A是Na2SO3
B. B、C反应的离子方程式可能是:SO+2H+===SO2↑+H2O
C. B溶于溴水中,不可能生成沉淀
D. 若A、B两溶液的pH=9,则两溶液中水电离的OH-的物质的量浓度之比为1:1
解析:显碱性的物质可能是NaOH、Na2SO3、NaHS,pH相等的A、B溶液c(A)<c(B),说明A是NaOH,B是Na2SO3(或NaHS),C的水溶液显酸性且为强电解质,应为硫酸;若B为NaHS,与溴水发生反应(HS-+Br2===S↓+2Br-+H+)会生成S沉淀;A为NaOH,水电离的OH-与溶液中H+浓度相同,为10-9 mol/L,B为能水解的盐,溶液中的OH-全部由水电离,其浓度为109-14 mol/L,故二者之比为1?104。
答案:B
11.温度相同、浓度相同的条件下,6种盐溶液的pH由小到大的排列顺序如下图所示。图中①②③可能分别是( )
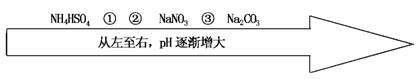
A.NH4NO3 (NH4)2SO4 CH3COONa
B.CH3COONH4 NH4Cl C6H5ONa
C.(NH4)2SO4 NH4Cl NaAlO2
D.(NH4)2SO4 NH4NO3 NaHCO3
解析:由题意可知,①②溶液的pH要小于NaNO3溶液,溶液呈酸性,而③溶液的碱性要比Na2CO3溶液弱,C6H5ONa、NaHCO3、CH3COONa溶液的碱性比Na2CO3溶液弱,分析知只有D项符合题意,即选D。
答案:D
10.现有X、Y、Z三种气体,相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
A.若三种气体物质的量相等,则它们的体积一定相等
B.等质量的三种气体,所含分子数目关系为N(X)>N(Z)>N(Y)
C.标准状况下,三种气体中分子间的平均距离均相同,分子质量也相等
D.20 ℃时,若2 mol Y与1 mol Z体积相等,则Y、Z气体所承受的压强比为2:1
解析:气体体积与温度、压强密切相关,因温度、压强不明确,A错;等质量的气体,分子数目与摩尔质量成反比,B错;因三种气体相对分子质量不同,故分子质量不等;由阿伏加德罗定律的推论知D对。
答案:D
9.下列离子方程式正确的是( )
A.向NaAlO2溶液中通入过量CO2:2AlO+CO2+3H2O===2Al(OH)3↓+CO
B.用惰性电极电解饱和MgCl2溶液:Mg2++2Cl-+2H2OMg(OH)2+H2↑+Cl2↑
C.向碘化钾溶液中通入臭氧:O3+2I-+3H2O===6OH-+I2
D.等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH+SO===BaSO4↓+2NH3·H2O
解析:CO2过量,A项反应产物应为Al(OH)3和NaHCO3;C项反应未配平,该反应一般写成O3+2I-+H2O===2OH-+I2+O2;D项,OH-应先与Fe2+反应生成,若OH-足量,再与NH反应,则该反应的离子方程式应为Ba2++2OH-+Fe2++SO===BaSO4↓+Fe(OH)2↓。
答案:B
8.在下列各溶液中,离子可能大量共存的是( )
A.透明的溶液中:Cu2+、Fe3+、NO、Cl-
B.使pH试纸变红的溶液中:K+、Na+、CO、Cl-
C.含有大量ClO-的溶液中:K+、H+、I-、SO
D.水电离产生的c(H+)=10-12 mol·L-1的溶液中:Na+、Fe2+、SO、NO
解析:B选项,pH试纸变红色,说明溶液呈酸性,不可能大量存在CO;C选项ClO-、H+、I-、SO不能大量共存;水电离产生的c(H+)=10-12 mol·L-1的溶液可能呈强酸性,也可能呈强碱性,强碱性溶液中不可能存在Fe2+,强酸性溶液中不可能存在Fe2+、NO。
答案:A
7.关于下列图示的说法不正确的是( )
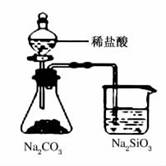
A.能证明非金属性:Cl>C>Si
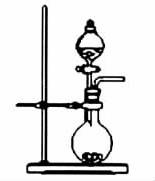
B.实验室制取少量的NH3或O2
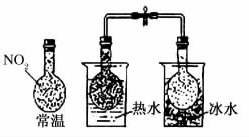
C.颜色深浅不同说明反应2NO2ƒN2O4是放热反应
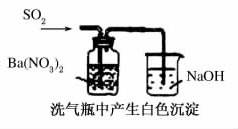
D.白色沉淀为BaSO4
解析:非金属性越强,最高价氧化物对应的水化物的酸性越强,盐酸不是氯元素最高价氧化物对应的水化物。
答案:A
6.A、B、C三种短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数。下列说法中不正确的是( )
|
A |
B |
|
C |
|
①B与C均存在同素异形体
②X的种类比Y的多
③A、B、C形成的简单氢化物中,A的氢化物沸点最高
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①④ B.③
C.② D.②③
解析:依题意,A为氮,B为氧,C为磷。氧的同素异形体有氧气和臭氧等,磷的同素异形体有白磷和红磷等,①正确;A的价态比C的多,②正确;水的沸点比NH3的高,③错误;磷酸与氨气可形成三种盐:磷酸铵、磷酸氢二铵、磷酸二氢铵,④正确。
答案:B
0.1NA
解析:18O中含有10个中子,故A正确;标准状况下四氯化碳为液态,不能用气体摩尔体积进行计算,故B错误;氦气是单原子分子,故C错误;在水溶液中,由于存在水的电离,醋酸根离子和氢氧根离子的数目之和为0.1NA,所以D错误。
答案:A
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下,2 g HO中含有的中子数为NA
B. 标准状况下,2.24 L四氯化碳中含碳原子数为0.1NA
C. 标准状况下,33.6 L氦气含有的原子数为3NA
D. 常温下,pH=1的1 L醋酸中,醋酸根离子的数目为
4.下列叙述中正确的是( )
A.熔融状态下能导电的物质一定是离子化合物
B.分子晶体的熔沸点一定比金属晶体的低
C.分子结构稳定的物质其熔沸点较高
D.有化学键断裂的变化不一定是化学变化
解析:A选项,金属熔化可以导电;B选项,水银熔沸点较低;C选项,分子结构稳定,不能说明分子间作用力大,如氮气结构稳定,但是熔沸点较低;D选项氯化钠熔化,有化学键断裂,但不是化学变化。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com