
题目列表(包括答案和解析)
9.(2010·石家庄质检(二))甲、乙为短周期元素的单质,丙、丁为氧化物,它们存在如下转化关系: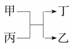 甲丙丁乙,则甲和乙可以是( )
甲丙丁乙,则甲和乙可以是( )
A.钠和氢气 B.镁和碳
C.氧气和硫 D.铝和铁
解析:选项A,若甲为Na,乙为H2,则丙为H2O,丁为NaOH,NaOH不是氧化物,不符合题意。选项B,若甲为Mg,乙为C,则丙为CO2,丁为MgO,符合题意。选项C,若甲为O2,乙为S,则丙为H2S,丁为H2O,H2S不是氧化物,不符合题意。选项D,铁不是短周期元素,不符合题意。
答案:B
8.(2010·唐山市联考)下列各组物质依次表示为a、b、c、d,图中箭头表示一步转化。满足如图所示转化关系的是( )
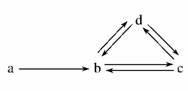
A.Na Na2O2 NaOH Na2CO3
B. S SO2 H2SO3 NaHSO3
C. Cu CuO Cu(OH)2 CuSO4
D. Si SiO2 H2SiO3 Na2SiO3
解析:选项A中NaOH、Na2CO3不能一步转化为Na2O2;选项C中CuO不能一步转化为Cu(OH)2,CuSO4不能直接转化为CuO;选项D中SiO2不能直接转化为硅酸,硅酸钠也不能直接转化为二氧化硅。
答案:B
7.(2010·唐山市联考)向含有下列离子的溶液中加入足量的NaOH溶液,静置,过滤,取出沉淀洗涤后,向沉淀中加入足量的盐酸,得到的溶液所含金属离子的种类与原溶液相同的是( )
A.Na+、Ag+、Mg2+ B.Fe2+、Mg2+、NH
C.Al3+、Ca2+、Cu2+ D.Mg2+、Fe3+、Cu2+
解析:沉淀加盐酸后,A中应无Na+,B中多了Fe3+,C中应无Al3+。
答案:D
6.(2010·郑州市质量预测)将一定量铁粉和铜粉的混合物加入由稀H2SO4和稀HNO3组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是( )
A.反应过程中不可能产生H2
B.剩余的金属粉末中一定有铜
C.往反应后的溶液中加入KSCN溶液会变血红色
D.往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少
解析:由金属单质的还原性强弱可知,首先参加反应的一定是活泼性强的铁,当铁反应完后,若溶液中还有H+与NO或Fe3+,这时才会有单质铜的溶解,所以,反应后的剩余金属有两种可能,一是铁与铜的混合物,二是只有铜一种单质。而当有未反应的金属存在时,则溶液中就不可能存在H+与NO或Fe3+。
答案:B
5.(2010·湖北省襄樊市调研)将6.4 g Cu加入到60 mL 2.0 mol/L的硫酸溶液中,无明显现象,再加入(或通入)足量的下列物质,铜能够完全溶解的是( )
A.NaNO3 B.O2
C.H2SO4 D.FeCl2
解析:选项A,在H2SO4溶液中加入NaNO3溶液,H2SO4提供的H+,NaNO3提供的NO不能使Cu全部溶解;选项B,通入O2,相当于Cu与O2反应生成CuO,生成的0.1 mol CuO能被含有0.12 mol H2SO4的溶液溶解;选项C,若加入稀H2SO4,Cu不溶解;选项D,FeCl2不能与Cu反应。
答案:B
4.(2010·湖北省八校联考)下列有关元素化合物的叙述中正确的是( )
A.碱金属原子的最外层电子数都是1,次外层电子数都是8
B.将SO2通入滴有紫色石蕊试液的水中,溶液变成红色
C.白磷易溶于水,不能保存在水中
D.高性能通信材料光导纤维的主要原料是单晶硅
解析:选项A,Li原子次外层电子数为2。选项B,SO2与H2O反应生成H2SO3,H2SO3使紫色石蕊试液变红。选项C,P4为非极性分子,不溶于H2O,也不与H2O反应,所以P4可保存在水中。选项D,制造光导纤维的材料为SiO2,不是Si。
答案:B
3.(2010·桂林市摸底考试)若向某溶液中加入适量的氯水后,溶液仍呈无色,则该溶液可能含有的离子是( )
A.Cu2+ B.Br-
C.SO D.Fe2+
解析:加入氯水后仍呈无色,说明原溶液是无色的,故不可能含有Cu2+、Fe2+,反应后仍呈无色,则说明没有Br2生成,C对。
答案:C
2.(2010·上海卷)下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液中
解析:本题考查元素化合物,意在考查考生对元素化合物知识的理解和分析能力。NO2通入FeSO4溶液中,NO2与水反应生成的HNO3能将Fe2+氧化为Fe3+,溶液由浅绿色变为黄色,A项错误;CaCl2溶液显中性,向其中通入CO2,无明显现象,B项正确;NH3通入AlCl3溶液中:Al3++3NH3·H2O===Al(OH)3↓+3NH,产生Al(OH)3沉淀,C项错误;SO2通入已酸化的Ba(NO3)2溶液中,HNO3能将SO2氧化为SO,最终得到BaSO4沉淀,D项错误。
答案:B
1.(2010·四川摸底考试)2009年10月6日瑞典皇家科学院宣布,英国华裔科学家高锟以及两名美国科学家威拉德·博伊尔和乔治·史密斯获得2009年诺贝尔物理学奖,以奖励他们在光纤和半导体领域上的开创性研究。下列有关光导纤维和半导体的说法中错误的是( )
A.二氧化硅是制备光导纤维的主要原料,光导纤维遇强碱会“断路”
B.作半导体材料的硅位于周期表中第三周期ⅣA族
C.工业上,利用二氧化硅热分解法冶炼硅
D.二氧化硅和硅的晶体类型相同
解析:二氧化硅是制备光导纤维的主要原料,二氧化硅溶于强碱,A项正确;工业上,用焦炭在高温下还原二氧化硅得到粗硅,粗硅经过精炼提纯得到高纯度硅,C项错误;二氧化硅和硅都属于原子晶体,D项正确。
答案:C
0.1 mol 4.4 g 25.2 g-19.0 g
故需通入4.4 g CO2,使0.1 mol Na2CO3全部转化为NaHCO3。
(2)依题意,19.0 g0.2 mol Na2CO3。
即要将0.1 mol NaHCO3变为0.1 mol Na2CO3,加入的某物质需满足3个条件:a.显碱性或能生成碱,b.含有Na元素;c.不引进其他杂质。①中根据Na守恒,0.05 mol某物质中需有0.10 mol Na,故符合条件的只有Na2O或Na2O2,②中根据Na守恒,0.10 mol某物质中需有0.10 mol Na,故符合条件的可有Na、 NaOH、NaH。
答案:(1)4.4 (2)①Na2O Na2O2 ②Na NaOH(或NaH)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com