
题目列表(包括答案和解析)
(二)验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,写出通入O2的过程中发生的化学反应方程式:______________________________________。
(2)继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
Ⅰ.当通入氧气的体积为V/2 mL时,则广口瓶①的气体体积为________;
Ⅱ.当广口瓶①的气体体积为V/2 mL时,则通入氧气的体积可能为________。
解析:检查装置气密性的关键首先需形成密封体系,通过装置中某处的液面变化来判断装置气密性是否良好,所以根据本装置的特点,其检查方法为:关闭K1、K2,打开K3,从滴定管③上口加水,没过广口瓶①中的长导管口,继续加水,使广口瓶①中长导管内外出现一段液柱,停止加水,静置一段时间后,若这段液柱不变,说明装置气密性好,反之,说明装置气密性不好。
(一)向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管③中液面与①相平并记录滴定管③的刻度。
(2)从导管a通入一定量的NO并准确测定通入NO的体积的主要操作:________________________________________________________;计算出通入的NO的体积为V mL(V<50)。
17.(10分)(2010·湖北省八校联考)某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理。
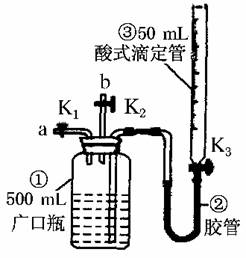
如何检查该装置气密性____________________________________________________________________。
16.(2010·云南省摸底考试)把x mL CO2通过足量的Na2O2后再与y mL NO混合。x与y之和为30。设充分反应后气体的体积缩小为15 mL,则x?y可能为( )
①1?: 1 ②2?: 1 ③5?: 4 ④7?: 5
A.只有① B.只有②
C.只有③④ D.①②③④
解析:2CO2+2Na2O2===2Na2CO3+O2,2NO+O2===2NO2。当x=y时,这两个反应均恰好反应完全,气体总体积减小15 mL;当x<y时,气体总体积减小值小于15 mL;当x>y时,则前一个反应导致气体减小0.5x mL,后一个反应导致气体减小0.5y mL,共减少(0.5x+0.5y)mL=15 mL。由此可知,当x≥y时,符合条件。
答案:D
第Ⅱ卷(非选择题,共52分)
15.(2010·四川省德阳市“一诊”考试)常温下,向100 mL某稀硫酸和稀硝酸的混合溶液中加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析错误的是( )
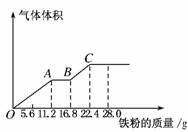
A.取10 mL原混合酸加水稀释至1 L后其pH=2
B.原混合酸中,NO物质的量为0.2 mol
C.原混合酸中,H2SO4物质的量浓度为4 mol·L-1
D.OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生的是氢气
解析:稀H2SO4和稀HNO3的混合溶液最多溶解19.2 g Cu,说明NO完全转化为NO,19.2 g Cu失去0.6 mol电子,设生成的NO为x mol,根据得失电子守恒有:3x=0.6,解得x=0.2,故原混合酸中HNO3的物质的量为0.2 mol。根据图示变化,加入Fe时,Fe首先与HNO3反应生成Fe(NO3)3、NO(OA段),然后过量的Fe与Fe(NO3)3反应生成Fe(NO3)2(AB段),最后Fe与H2SO4反应产生H2(BC段)。OA段:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,0.2 mol HNO3只能溶解0.05 mol Fe,而实际溶解了0.2 mol Fe,说明H2SO4提供了0.6 mol H+。BC段:Fe+H2SO4===FeSO4+H2↑,n(H2SO4)=n(Fe)=0.1 mol,故原混合酸中含有0.4 mol H2SO4,其浓度为0.4 mol/0.1 L=4 mol·L-1。原混合酸中c(H+)=(0.2 mol+0.8 mol)/0.1 L=10 mol·L-1,取10 mL原混合酸稀释至1 L,溶液中c(H+)=0.1 mol·L-1,pH=1。综合上述,选项A错误。
答案:A
14.(2010·郑州市质量预测)标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是( )
A.所得沉淀为0.05 mol的BaSO4
B.混合气体中SO2的体积为0.448 L
C.a L混合气体的物质的量为0.04 mol
D.a的取值范围为0.672<a<0.896
解析:由最终生成的沉淀为11.65 g,可知n(BaSO4)=0.05 mol;由S原子守恒可得:n(SO2)+3n[Fe2(SO4)3]=0.05 mol,故n(SO2)=0.02 mol,即为0.448 L;若混合气体的物质的量为0.04 mol,SO2与Cl2恰好完全反应,不能使硫酸铁溶液褪色,故C错误。
答案:C
13.(2010·北京市海淀区期中)下列说法不正确的是( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失
B. 向铜粉中加入稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,铜粉溶解
C. 向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸,沉淀全部溶解
D. 向MgCl2溶液中滴加NaOH溶液,产生白色沉淀,再加入FeCl3溶液,沉淀逐渐变为红褐色
解析:向AlCl3溶液中滴加氨水,产生氢氧化铝白色沉淀,它能溶解于盐酸中,A项正确;在金属活动顺序表中,铜位
于氢的后面,故向铜粉中加入稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,溶液中存在H+、NO,相当于稀硝酸,铜粉溶解,B项正确;向BaCl2溶液中加入Na2SO3溶液,产生BaSO3沉淀,再加入硝酸,BaSO3被氧化成BaSO4,C项不正确;向MgCl2溶液中滴加NaOH溶液,产生氢氧化镁白色沉淀,再加入FeCl3溶液,由于氢氧化铁溶解度比氢氧化镁小,故生成红褐色Fe(OH)3沉淀,D项正确。
答案:C
12.(2010·云南省摸底考试)已知AgCl能溶于氨水而生成[Ag(NH3)2]+。NH4Cl溶液和AgNO3溶液混合后,再滴入NaOH溶液,溶液中沉淀量(y)与NaOH溶液加入量(x)的关系曲线不可能是( )
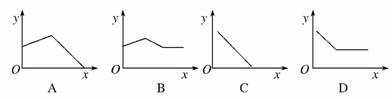
解析:分析时应注意考虑到NH4Cl溶液和AgNO3溶液混合后,二者是否能恰好反应完,若不能,AgNO3是否过量,因为Ag+在碱性条件下可生成AgOH沉淀。若AgNO3过量,加入NaOH后,开始时沉淀量增加,后来因有一部分AgCl沉淀转化为[Ag(NH3)2]+而减少,因NH的量不足,故沉淀不可能全部转化为[Ag(NH3)2]+,A错B对;若混合前n(NH4Cl)≥2n(AgNO3),加入足量NaOH后沉淀全部溶解,C对;若2n(AgNO3)>n(NH4Cl)>n(AgNO3),则D对。
答案:A
11.(2010·四川省摸底考试)下列化学实验事实及其解释都正确的是( )
A.向碘水中滴加溶剂X,振荡静置后分层,X试剂层呈紫红色且在上层,说明可用X从碘水中萃取碘
B. 向SO2水溶液中滴加盐酸酸化的硝酸钡溶液,无明显现象,说明BaSO3溶于盐酸
C. 向0.1 mol·L-1NaNO2溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明NO具有氧化性
D. 在含有KSCN的氯化铁溶液中加入铜粉,振荡,颜色褪去,说明发生了反应:2Fe3++3Cu===3Cu2++2Fe
解析:依题意,X与碘水不反应,且X与水不互溶,碘在X中的溶解度大于水,A项正确;硝酸钡中含有NO,在酸性条件下氧化二氧化硫生成SO,应生成白色硫酸钡沉淀,B项错误;高锰酸钾是强氧化剂,会氧化NO,故NO表现还原性,C项错误;铜还原铁离子生成亚铁离子,不能将其还原成铁单质,因为铁比铜活泼。
答案:A
10.(2010·河南省调研)在200 mL 1mol·L-1的NaHCO3溶液中,加入一定量的单质或化合物X,恰好使其转化为只含Na2CO3溶质的溶液,实现转变的物质X有多种,符合条件的一组是( )
|
选项 |
A |
B |
C |
D |
|
X的化学式 |
Na |
Na2O |
Na2O2 |
NaOH |
|
加入X的质量(g) |
4.8 |
6.4 |
7.8 |
16.0 |
解析:本题考查了元素及其化合物的有关计算。NaOH+NaHCO3===Na2CO3+H2O,则恰好使NaHCO3溶液转化为只含Na2CO3溶质的溶液,需要NaOH 0.2 mol,A、B与水反应生成的NaOH均大于0.2 mol,D中NaOH为0.4 mol,C中7.8 g Na2O2与水反应恰好生成0.2 mol NaOH。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com