
题目列表(包括答案和解析)
18.(8分)(2010·江西省联考)短周期元素W、X、Y、Z在元素周期表中的相对位置如下表所示。其中X、Y、Z三种元素的质子数之和为21。
|
W |
|
|
|
|
|
|
|
|
|
|
|
X |
Y |
Z |
|
|
(1)W与Z可形成原子个数比为1?1的化合物,其电子式为________。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是____________________(用化学用语表示);该溶液中各种离子浓度由大到小的顺序为______________________。
(3)由XW4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为________________。
(4)已知:2YZ2(g)⇌Y2Z4(g);ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2 L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
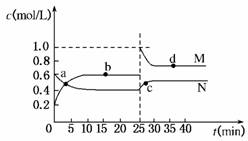
①a、b、c、d四个点中,化学反应处于平衡状态的是________点。
②25 min时,增加了________(填物质的化学式)________mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是________(填字母)。
解析:X、Y、Z分别为ⅣA、ⅤA、ⅥA族元素,根据其质子数之和为21,可以推断X为C,Y为N,Z为O,进而推断W为H。(1)H和O形成的原子个数比为1:1的化合物为H2O2,其电子式为H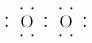 ?H。(2)N的最高价氧化物对应的水化物HNO3与其氢化物NH3恰好反应生成NH4NO3,由于NH水解,溶液显酸性。(3)CH4、O2和KOH溶液组成的燃料电池中,负极CH4发生氧化反应,电极反应式为:CH4-8e-+10OH-===CO+7H2O。(4)①图象中b、d点处于平衡状态。②根据图象,M曲线代表NO2,N曲线代表N2O4,25 min时NO2增加的物质的量为:(1.0-0.6)mol/L×2 L=0.8 mol。③NO2的体积分数越大,气体颜色越深,故气体颜色由深到浅的顺序为cdba。
?H。(2)N的最高价氧化物对应的水化物HNO3与其氢化物NH3恰好反应生成NH4NO3,由于NH水解,溶液显酸性。(3)CH4、O2和KOH溶液组成的燃料电池中,负极CH4发生氧化反应,电极反应式为:CH4-8e-+10OH-===CO+7H2O。(4)①图象中b、d点处于平衡状态。②根据图象,M曲线代表NO2,N曲线代表N2O4,25 min时NO2增加的物质的量为:(1.0-0.6)mol/L×2 L=0.8 mol。③NO2的体积分数越大,气体颜色越深,故气体颜色由深到浅的顺序为cdba。
答案:(1)H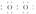 H (2)NH+H2ONH3·H2O+H+ c(NO)>c(NH)>c(H+)>c(OH-) (3)CH4-8e-+10OH-===CO+7H2O (4)①b、d ②NO2 0.8 ③cdba
H (2)NH+H2ONH3·H2O+H+ c(NO)>c(NH)>c(H+)>c(OH-) (3)CH4-8e-+10OH-===CO+7H2O (4)①b、d ②NO2 0.8 ③cdba
17.(8分)(2010·福建卷)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
|
|
J |
|
|
|
|
|
|
|
R |
|
(1)M的离子结构示意图为________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为________________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(ΔH>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的 物质的量 |
加入甲的 物质的量 |
|
y |
甲的物 质的量 |
平衡常 数K |
甲的转化率 |
生成物物质 的量总和 |
(5)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为______________________。
解析:本题考查元素的推断,意在考查考生的分析推断能力。根据J元素最低负化合价的绝对值与其原子最外层电子数相等,则J的最低负价为-4价,位于ⅣA族,又五种元素均为短周期主族元素,则J为C,R为S,T的原子序数比R大,则T只能为Cl;根据M是地壳中含量最多的金属元素,则M为Al。(1)Al3+的结构示意图为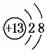 ,Cl位于元素周期表第ⅦA族。(2)C和H组成的含6个原子的化合物为乙烯,其结构简式为CH2===CH2。(3)Al和Cl形成的化合物为AlCl3,在潮湿的空气中发生水解反应,产生白色烟雾。(4)L的最简单气态氢化物甲的溶液显碱性,则L为N,甲为NH3。①结合提供信息,可以推断NH3和H2O2反应生成N2和H2O。②对于平衡:2NH3N2+3H2,升高温度,平衡向正方向移动,则n(NH3)减小,a对;升高温度,平衡向正方向移动,c(NH3)减小,c(N2)和c(H2)均增大,则平衡常数增大,b错;加入H2,c(H2)增大,平衡向逆方向移动,NH3的转化率减小,c对;加入NH3,平衡向正方向移动,生成物物质的量总和增大,d错。
,Cl位于元素周期表第ⅦA族。(2)C和H组成的含6个原子的化合物为乙烯,其结构简式为CH2===CH2。(3)Al和Cl形成的化合物为AlCl3,在潮湿的空气中发生水解反应,产生白色烟雾。(4)L的最简单气态氢化物甲的溶液显碱性,则L为N,甲为NH3。①结合提供信息,可以推断NH3和H2O2反应生成N2和H2O。②对于平衡:2NH3N2+3H2,升高温度,平衡向正方向移动,则n(NH3)减小,a对;升高温度,平衡向正方向移动,c(NH3)减小,c(N2)和c(H2)均增大,则平衡常数增大,b错;加入H2,c(H2)增大,平衡向逆方向移动,NH3的转化率减小,c对;加入NH3,平衡向正方向移动,生成物物质的量总和增大,d错。
答案:(1)  ⅦA (2)CH2=CH2
ⅦA (2)CH2=CH2
(3)AlCl3+3H2O===Al(OH)3+3HCl↑
(4)①2NH3·H2O+3H2O2===N2↑+8H2O
或2NH3+3H2O2===N2↑+6H2O
②ac
(5)CS2(l)+O2(g)===CO2(g)+SO2(g)
ΔH=-215 kJ·mol-1
16.(2010·湖北省八校联考)用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解,此时若加入100 g质量分数为36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是( )
A.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.电解过程中转移电子的物质的量约为8 mol
D.原某浓度的NaCl溶液中溶有117 g NaCl
解析:由于电解NaCl溶液时,阳极得到Cl2,阴极得到H2,电解H2O时阴极产生的气体比阳极多,故选项A、B错误。选项C,电解后加入100 g质量分数为36.5%的浓盐酸能恢复到原来NaCl溶液,说明电解过程中电解了1 mol NaCl、3.5 mol H2O,电解1 mol NaCl转移1 mol电子,电解3.5 mol H2O转移7 mol电子,故共转移8 mol 电子。选项D,原NaCl溶液中含有的NaCl的质量为58.5 g。
答案:C
第Ⅱ卷(非选择题,共52分)
15.(2010·石家庄质检(二))如图所示,X、Y、Q、W都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是( )

A.电源的M极为正极
B.甲装置中溶液的pH减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1?1
D.欲用乙装置给铜镀银,U极应该是Ag,电镀液选择AgNO3溶液
解析:选项A,因Fe(OH)3胶体微粒带正电荷,W极附近颜色加深,说明W与电源负极相连,故M为电源的正极,N为电源的负极。选项B,电解CuSO4溶液时产生H2SO4导致溶液pH减小。选项C,根据反应:2CuSO4+2H2O===2Cu+O2↑+2H2SO4,X极上产生O2单质,Y极上产生Cu单质,二者物质的量之比为1?2。选项D,U为电镀池的阳极,Ag为阳极而溶解,AgNO3电镀液中的Ag+在R上析出而镀上Ag。
答案:C
14.下列说法不正确的是( )
A.Na2CO3溶液中c(OH-)大于c(HCO)
B.水的离子积常数为KW,若溶液中c2(OH-)=KW,溶液pH可能小于7
C.1 mol/L的CH3COOH溶液加水稀释时,溶液中某种离子浓度可能增大
D.在CH3COOH溶液中加入溶于水溶液呈碱性的固体物质,平衡一定向电离方向移动
解析:A选项,CO水解,生成HCO和OH-,HCO再水解生成H2CO3和OH-,所以c(OH-)大于c(HCO);B选项中,由c2(OH-)=KW可求出c(OH-)=c(H+),由于未指明温度,所以溶液的pH可能小于7;C选项中加水,溶液中c(OH-)增大;D选项,CH3COONa水溶液呈碱性,在CH3COOH溶液中加入CH3COONa平衡向电离的逆方向移动,所以D选项不正确。
答案:D
13.(2010·江西省模拟)下列有关化学量的比较,前者一定大于后者的是( )
A.N和P的原子半径
B.同温下,相同物质的量浓度的CH3COONa溶液和CH3COONH4溶液中水的电离程度
C.相同条件下,1.0 mol/L的氨水与10.0 mol/L的氨水的密度
D.r(K+)/r(Cl-)与r(H-)/r(H+)的比值[r(X)表示某离子半径]
解析:A项中N原子半径比P原子小;B项中醋酸铵溶液中铵根离子的存在对醋酸根离子的水解有促进作用,故醋酸铵溶液中水的电离程度大;C项中氨水的浓度越大,密度越小;D项中r(K+)<r(Cl-),故r(K+)/r(Cl-)<1,而r(H-)>r(H+),故r(H-)/r(H+)>1。
答案:C
12.(2010·湖北省八校联考)北京大学教授、著名的化学家和教育家徐光宪教授,是我国理论化学和稀土化学的奠基人之一,2008年获得“国家最高科学技术奖”,以表彰他在稀土理论方面作出的贡献,稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应并产生气体。已知:铈常见的化合价为+3价和+4价,且Ce4++Fe2+===Ce3++Fe3+。下列说法正确的是( )
A.用Pt作阴极,Fe作阳极,电解熔融CeO2,可在阳极获得铈
B.将少量的碘化亚铁溶液滴加到Ce(SO4)2溶液中,其离子方程式为:Ce4++Fe2+===Ce3++Fe3+
C.金属铈着火,可采用普通的泡沫灭火器灭火
D.金属铈可浸于煤油中保存,储存在阴凉、通风的地方,要远离火种和热源
解析:选项A,Fe为阳极为非惰性电极,电解时Fe溶解,在阳极得不到Ce。选项B,由于I-的还原性大于Fe2+,所以加入少量Ce(SO4)2溶液时,优先氧化I-而不是Fe2+。选项C,Ce能与H2O发生反应,不能用泡沫灭火剂灭火。选项D,根据信息和Na的性质推知其保存方法正确。
答案:D
11.某离子晶体R的晶体结构最小的重复单元如图所示,其中A为阴离子,B为阳离子,位于顶点和面心,有关叙述正确的是( )
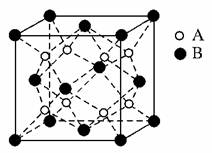
A.R的化学式为AB2
B.晶体R的熔点一定比金属晶体的熔点高
C.晶体R中,与B紧邻的A构成正八面体
D.R的电子式可能为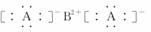
解析:晶体R的最小结构单元中,含A 8个,含B 8×1/8+6×1/2=4个,其化学式为BA2;金属晶体的熔点有低有高,因而无法比较;晶体R中,与B紧邻的A有8个,构成正方体。
答案:D
10.(2010·黄冈市质检)德国科学家格哈德·埃特尔研究的内容能帮助我们理解铁会生锈、燃料电池如何工作、催化剂如何工作而获得2007年诺贝尔化学奖。下列相关说法正确的是( )
A.含碳的生铁在发生电化学腐蚀的时候铁一般作正极
B.C2H6、O2、KOH构成的燃料电池放电一段时间后,负极周围的pH升高
C.CO、O2、KOH构成的燃料电池的负极反应式为:CO-2e-+4OH-===CO+2H2O
D.SO2被氧化为SO3时需使用V2O5作催化剂,这样可以提高SO2的转化率
解析:A项中生铁发生电化学腐蚀时,铁作负极;B项中乙烷、氧气和KOH燃料电池,在负极乙烷失电子生成的CO2要消耗OH-,使溶液的pH减小;D项中催化剂不能使平衡发生移动,不影响SO2的转化率。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com