
题目列表(包括答案和解析)
6.(2010·郑州市质量预测)传统的自来水消毒常采用漂白粉等强氧化剂,但其产生的有机氯对人体有一定的危害。一种新型的消毒剂--高铁酸盐(如Na2FeO4或K2FeO4)能有效地杀灭水中的细菌和病毒,同时其产物在水中经过变化后能除去水中的微细悬浮物。在以上变化过程中不可能涉及的变化有( )
A.电离 B.水解
C.置换反应 D.氧化还原反应
解析:在用Na2FeO4(K2FeO4)消毒净水的过程中,首先是Na2FeO4(K2FeO4)电离产生Na+(K+)和FeO,然后是FeO表现氧化性,杀灭水中的细菌和病毒,而本身被还原为Fe3+,Fe3+在水中水解,生成Fe(OH)3胶体,吸附悬浮物使之沉降而除去,所以本题答案为C。
答案:C
5.(2010·河南省调研)同温同压下,A容器中的H2和B容器中的NH3所含氢原子数相等,则两个容器的体积比是( )
A.3:2 B.1:3
C.2:3 D.1:2
解析:由题意知氢气与氨气的物质的量之比为3?2,根据阿伏加德罗定律,同温同压下体积之比等于物质的量之比,A正确。
答案:A
4.(2010·北京市检测)分类方法在化学学科的发展中起到了重要的作用。下列分类标准合理的是( )
A.根据纯净物的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
解析:选项B,根据电解质能否完全电离,将电解质分为强电解质和弱电解质。选项C,分散系的分类依据是分散质微粒大小,而不是是否具有丁达尔效应。选项D,根据反应中的能量变化,将反应分为吸热反应和放热反应。
答案:A
3.(2010·四川省摸底考试)下列每组物质分别存在于同一化学反应中,其中化学方程式中H2SO4的化学计量数最大的是( )
A.H2O、KMnO4、FeSO4、H2SO4(稀)、Fe2(SO4)3、MnSO4、K2SO4
B.KMnO4、O2、H2O2、H2SO4(稀)、H2O、K2SO4、MnSO4
C.KMnO4、H2O、H2SO4(稀)、K2SO4、MnSO4、SO2
D.H2C2O4、KMnO4、K2SO4、MnSO4、CO2、H2O、H2SO4(稀)
解析:A项各物质间反应的方程式为2KMnO4+10FeSO4+8H2SO4===K2SO4+2MnSO4+5Fe2(SO4)3+8H2O;B项各物质间反应的方程式为2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O;C项各物质间反应的方程式为2KMnO4+5SO2+2H2O===K2SO4+2MnSO4+2H2SO4;D项各物质间反应的方程式为2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O。
答案:A
2.(2010·唐山市联考)下列有关化学用语使用正确的是( )
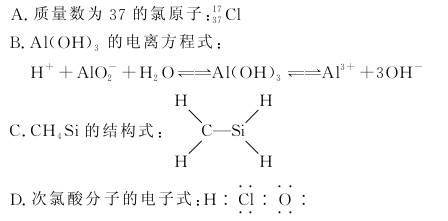
解析:质量数是37的氯原子表示为Cl,A错;氢氧化铝既能发生酸式电离,又能发生碱式电离,B正确;C、Si都是第ⅣA族元素原子,在分子中应该满足四键原则,故CH4Si的结构式中C原子与Si原子之间是双键,即CH4Si可以认为Si取代了乙烯分子中的一个碳原子,C错;次氯酸分子的电子式是:H?····?····?,D错。
答案:B
1.(2010·山东卷)16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
A.16O2与18O2互为同分异构体
B.16O与18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12 L16O2和1.12 L18O2均含0.1 NA个氧原子
解析:本题考查阿伏加德罗常数及同位素的概念,意在考查考生的分析推理能力和实际运用知识的能力。同分异构体是指分子式相同而结构不同的化合物,A选项错误;16O和18O互为同位素,质子数相同,电子数相同,所以两者的核外电子排布方式相同,B选项错误;16O和18O都是氧原子,而化学变化中的最小微粒是原子,所以化学变化不能实现16O和18O的转化,C选项错误;标况下,1.12 L16O2和1.12 L18O2的物质的量均为0.05 mol,则所含氧原子均为0.1 mol,D选项正确。
答案:D
22.(8分)(2010·云南省检测)用如图所示的装置进行电解。A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。则
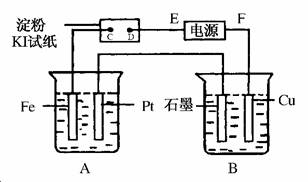
(1)电源的F端为________极。
(2)A中发生反应的化学方程式为__________________。
(3)在B中观察到的现象是________________、________________、________________。
(4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168 L,B中析出硫酸钠晶体w g。若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000 mL,则
①A溶液的pH为________。
②电解前饱和Na2SO4溶液的质量分数为________(列出算式即可)。
解析:以湿润的淀粉KI试纸为研究对象。由于C端变为蓝色,可知C端有I2生成:2I--2e-===I2。该极为阳极,则F连接电源正极。由题意可知:4H+-O2+2H2,根据气体体积可求出n(H+)、c(H+)及pH。对于B池,阳极反应式为:Cu-2e-===Cu2+,阴极反应式为:2H++2e-===H2↑。电解的总反应式为Cu+2H2OCu(OH)2↓+H2↑。当阴极析出0.005 mol H2,耗水0.01 mol,析出晶体的质量和消耗的水的质量即为饱和溶液的质量。
答案:(1)正 (2)4AgNO3+2H2O4Ag+O2+4HNO3 (3)石墨极有气泡产生 Cu极周围变蓝色 溶液中有蓝色沉淀生成 (4)①2 ②×100%
21.(10分)(2010·重庆卷)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为________mol/L;生成SO3的化学反应速率为________mol/(L·min)。②工业制硫酸,尾气SO2用________吸收。
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。
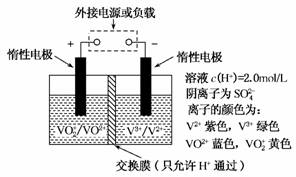
①当左槽溶液颜色逐渐由黄变蓝,其电极反应式为__________________________________。
②充电过程中,右槽溶液颜色逐渐由________色变为________色。
③放电过程中氢离子的作用是________和________;
充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为________。
解析:本题为化学反应原理内容,主要考查了化学反应速率及电化学。
生成b mol SO3需要反应物SO2 b mol,故起始时SO2浓度为(a+b)mol/L。
v(SO3)=b mol/L÷t min=mol/(L·min)。
②二氧化硫尾气用碱液(氨水)吸收。
(2)①由黄色变为蓝色,说明VO生成VO2+,V化合价由+5价降为+4价,被还原。②充电过程中,右槽中发生还原反应,V3+变为V2+,颜色由绿色变为紫色。③放电时,氢离子参与正极的还原反应,生成水;充电时,转移的电子为0.5 mol时,生成的H+物质的量为1 mol,由于H+可以通过交换膜,其中0.5 mol H+进入右槽,故左槽中H+的变化量为0.5 mol。
答案:(1)①a+b b/t ②氨水
(2)①VO+2H++e-===VO2++H2O
②绿 紫
③参与正极反应 通过交换膜定向移动使电流通过溶液 0.5 mol
20.(10分)(2010·江西省五校联考)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:

(1)如图是N2和H2反应生成2 mol NH3过程中的能量变化示意图,请计算每生成1 mol NH3放出的热量为________。
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2通电(一定条件2NH3,则在电化学合成氨的过程中,阴极反应式为__________________________。
(3)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)⇌2NH3(g);ΔH<0,其化学平衡常数K与t的关系如下表:(已知K=,c(N2)、c(H2)、c(NH3)均为平衡浓度)
|
t/K |
298 |
398 |
498 |
…… |
|
K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试确定K1的相对大小,K1________4.1×106(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据的是________(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性,这是NH水解的缘故。则NH4Cl溶于重水(D2O)生成的一水合氨和水合氢离子的化学式分别是____________________。
②室温下,某氨水的pH=x,某盐酸的pH=y,x+y=14且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为________。
A.c(Cl-)>c(NH)>c(H+)>c(OH-)
B.c(NH)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH)>c(OH-)>c(H+)
D.c(NH)>c(Cl-)>c(H+)>c(OH-)
解析:(1)生成1 mol NH3放出的热量==46.1 kJ。
(2)N2获得电子生成NH3:N2+6H++6e-===2NH3。
(3)①升高温度平衡向逆反应方向移动,K值减小,故K1<4.1×106。
(4)①D2O自身发生电离生成的水合氢离子为D3O+。根据水解规律,NH与D2O电离出的OD-结合生成NH3·HDO。
②反应后溶液呈碱性,溶质为NH3·H2O、NH4Cl的混合物,故离子浓度大小顺序为:c(NH)>c(Cl-)>c(OH-)>c(H+)。
答案:(1)46.1 kJ
(2)N2+6H++6e-===2NH3
(3)①< ②C
(4)①NH3·HDO和D3O+ ②B
19.(8分)今有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比1?1或2?1形成化合物。CB可与EA2反应生成C2A与气态物质EB4。
(1)写出元素名称:A________,B________,C________,D________。
(2)画出E的原子结构示意图________,EB4的电子式为________。
(3)比较EA2与EB4的熔点高低________。
(4)写出D单质与CuSO4溶液反应的离子方程式________________________________________________________________________
________________________________________________________________________。
解析:解答此题的关键在于分析EB4中元素E只能是ⅣA族元素C或Si。由核电荷数按C、A、B、D、E的顺序增大,猜想E为Si,B为F。则化合物CB中C为+1价,由C2A可知A为-2价,可能为O。能与O按原子个数比1?1或2?1形成化合物的元素只能是H或Na,即C为H,D为Na。代入验证,符合题意。
答案:(1)氧 氟 氢 钠
(2) 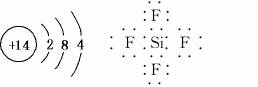
(3)SiF4<SiO2
(3)2Na+2H2O+Cu2+===Cu(OH)2↓+2Na++H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com