
题目列表(包括答案和解析)
2.下列有关化学用语正确的是( )
A.苯酚钠的结构简式: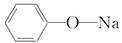
B.NaClO的电子式为:Na+[∶····∶····∶]-
C.NaCl晶胞结构示意图: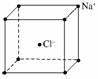
D.Cl-的结构示意图: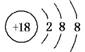
解析:A选项苯酚钠属于离子化合物,苯酚根离子和钠离子之间以离子键结合;C选项为氯化铯的晶胞结构示意图;D选项Cl原子核内有17个质子,带17个单位的正电荷。
答案:B
1.人类始祖“阿尔迪”被世界著名杂志《时代》评为2009年世界十大科技发现之首,人类始祖距今已有440万年。碳有三种核素:C是放射性元素,可根据其半衰期测定文物年代,C和C在自然界中稳定存在。下列有关说法正确的是( )
A.C、C、C互为同素异形体
B.等物质的量的C、C、C,中子数之比为12:13:14
C.阿伏加德罗用C做实验测定阿伏加德罗常数
D.m g C含质子数为2m×6.02×1023
解析:C、C、C是一组质子数相同,中子数不同(质量数不同)的原子(也称为核素),互为同位素,同种元素组成不同性质的单质,如金刚石、石墨、C60互为同素异形体,A选项错误;原子中,中子数等于质量数减去质子数,故C、C、C的中子数依次为6、7、8,B选项错误;m g C中所含质子的物质的量为×6 mol= mol,故质子数为×6.02×1023,D选项错误。
答案:C
0.5 a
n(O2) 2n(O2)a
则n(CH3OH)(E2-E1)=2n(O2)a,
即n(CH3OH):n(O2)=2a/(E2-E1),
则n(CH3OH):n(空气)=2a/5(E2-E1)。
22.(2009·安徽)(10分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
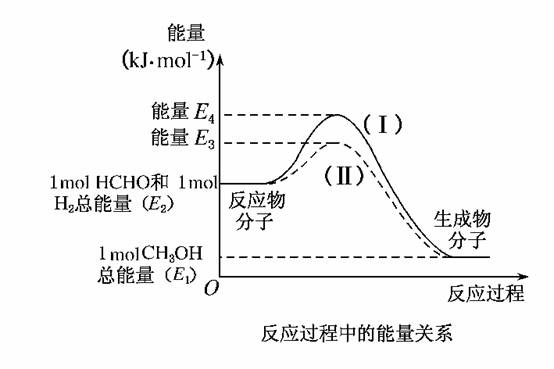
(1)甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
(2)过程Ⅰ与过程Ⅱ的反应热是否相同?________,原因是____________________________________________________________。
(3)写出甲醇催化脱氢转化为甲醛的热化学反应方程式______________________________________________。
(4)甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700°C,需向体系中通入空气,则进料甲醇与空气的物质的量理论比值为多少?[假设:H2(g)+O2(g)H2O(g);ΔH=-akJ·mol-1,空气中氧气体积分数为0.2]
答案:(1)吸热 (2)相同 一个化学反应的反应热仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关
(3)CH3OH(g)HCHO(g)+H2(g);ΔH=(E2-E1)kJ·mol-1
(4)CH3OH(g)HCHO(g)+H2(g);ΔH=(E2-E1)kJ·mol-1
1 (E2-E1)
n(CH3OH) n(CH3OH)(E2-E1)
H2(g)+O2(g)H2O(g);ΔH=-akJ·mol-1
21.(2010·石家庄质检(一))(6分)已知几种离子的还原能力强弱顺序为I->Fe2+>Br-。
(1)向含1 mol FeI2和2 mol FeBr2的溶液中通入3 mol Cl2后,溶液中各种离子的物质的量之比是________(不计H+和OH-)。
(2)向40 mL FeBr2溶液中通入0.672 L Cl2(标准状况),充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,求原FeBr2溶液的物质的量浓度(要求写出简单的计算过程)。
解析:(1)根据题意知,离子的还原性顺序是I->Fe2+>Br-,故通入氯气时先氧化I-,然后氧化Fe2+,最后才氧化Br-,当通入3 mol Cl2后,先氧化全部I-、Fe2+,最后再氧化1 mol Br-,故溶液中除了H+、OH-外,剩余Br- 3 mol,生成Fe3+3 mol,生成Cl- 6 mol,故n(Fe3+)?n(Br-)?n(Cl-)=1?1?2。
(2)n(Cl2)=0.672 L÷22.4 L·mol-1=0.03 mol
所以n(Cl-)=0.03 mol×2=0.06 mol
n(Br-)=0.06 mol
由题意可推知,反应后溶液中的Fe2+全部转化为Fe3+
由电荷守恒得:n(Fe3+)=0.06 mol×2÷3=0.04 mol
根据铁元素守恒得:n(FeBr2)=n(Fe3+)
∴c(FeBr2)=0.04 mol÷0.04 L=1 mol·L-1。
答案:(1)n(Fe3+)?n(Br-)?n(Cl-)=1?1?2
(2)解:n(Cl2)=0.672 L÷22.4 L·mol-1=0.03 mol
所以n(Cl-)=0.03 mol×2=0.06 mol
n(Br-)=0.06 mol
由题意可推知,反应后溶液中的Fe2+全部转化为Fe3+
由电荷守恒得:n(Fe3+)=0.06 mol×2÷3=0.04 mol
根据铁元素守恒得:n(FeBr2)=n(Fe3+)
∴c(FeBr2)=0.04 mol÷0.04 L=1 mol·L-1。
0.(4)0.004
(5)016 17
20.(2009·天津十二校模拟考试)(10分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁、铝的合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。向反应结束后的溶液中逐滴加入2 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为______________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为__________________________。
(3)在EF段,沉淀的物质的量减少,写出此阶段发生反应的化学方程式______________________________。
(4)A与B相差________mol。
(5)B点对应沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为________mL。
解析:由题给信息知,合金与稀硝酸反应时,还原产物为NH,反应后的溶液中除了NH外还有Fe3+和Al3+,OC段是中和过量的硝酸,所以无沉淀生成,CD段发生的反应为Fe3++3OH-===Fe(OH)3↓、Al3++3OH-===Al(OH)3↓,DE段沉淀的量不变,说明Fe3+和Al3+沉淀完全,OH-与NH反应生成NH3·H2O,到EF段时发生的反应为Al(OH)3+OH-===AlO+2H2O,F点之后Al(OH)3沉淀完全溶解。(4)从EF段入手,可以求出Al3+的量,此阶段消耗NaOH的物质的量为0.004 mol,则Al(OH)3的物质的量也为0.004 mol,所以B和A的差值为0.004 mol。(5)由DE段可以求出n(NH)=0.006 mol,则硝酸被还原成NH共转移的电子数为0.006 mol×8=0.048 mol,而化合价升高的有Fe-Fe3+-3e-、Al-Al3+-3e-,因为n(Al3+)=0.004 mol,则转移电子0.012 mol,所以铁被氧化时转移了0.036 mol电子,可得n(Fe3+)=0.012 mol,两沉淀总物质的量为(0.012+0.004)=0.016 mol,根据Fe(NO3)3-Fe(OH)3-3NaOH,Al(NO3)3-Al(OH)3-3NaOH知CD段消耗NaOH溶液的体积为=0.024(L),所以C点对应NaOH溶液的体积为41-24=17(mL)。
答案:(1)H++OH-===H2O
(2)NH+OH-===NH3·H2O
(3)NaOH+Al(OH)3===NaAlO2+2H2O
19.(2010·云南省摸底考试)(10分)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40-50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式:____________________。
(3)CuH溶解在稀盐酸中生成的气体是________(填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:________________________________________________________________________。
解析:由CuSO4+“另一物质”―→CuH知,反应中铜元素价态降低,故“另一物质”是还原剂。CuH中铜、氢元素均处于低价态,与强氧化剂氯气反应时,均可被氧化而生成CuCl2、HCl。CuH溶于稀盐酸时,氢元素会发生价态归中型的氧化还原反应生成氢气。CuH与稀硝酸反应会被氧化成Cu2+与+1价氢。
答案:(1)还原剂 (2)2CuH+3Cl22CuCl2+2HCl (3)H2 (4)CuH+3H++NO===Cu2++2H2O+NO↑
18.(2010·襄樊市调研)(7分)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1流感疫情,随后也不断蔓延我国各地。防控专家表示。含氯消毒剂和过氧化物消毒剂可防甲型H1N1流感。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。请写出反应的离子方程式__________________________。
(2)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是________。
A.MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是________。
解析:(1)KClO3→ClO2过程中Cl的化合价降低,因此反应中KClO3作氧化剂,则Na2SO3作还原剂,反应后生成Na2SO4。再根据得失电子守恒和质量守恒配平离子方程式。(2)过碳酸钠与MnO2反应,MnO2会催化H2O2的分解,该反应中过碳酸钠既发生氧化反应又发生还原反应;过碳酸钠与KMnO4反应,KMnO4作氧化剂,H2O2作还原剂,过碳酸钠发生氧化反应;过碳酸钠与稀盐酸反应,稀盐酸与碳酸钠发生复分解反应;过碳酸钠与Na2SO3反应,Na2SO3作还原剂,H2O2作氧化剂,过碳酸钠发生还原反应。(3)配平该离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O,当有5 mol HClO2发生分解反应时,转移电子为4 mol,因此当1 mol HClO2发生分解反应时,转移的电子个数为0.8 NA。
答案:(1)2ClO+SO+2H+===2ClO2↑+SO+H2O (2)D (3)0.8×6.02×1023
17.(2010·赣州市质检)(9分)按要求回答下列问题:
(1)0.01 mol/L的硫酸氢钠溶液,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为_____________________________________________。
(2)配平 Cr2O+ I-+ H+―→ Cr3++ I2+ H2O
(3)已知1 g乙醇完全燃烧生成液态水放出29.72 kJ的热量。写出该反应的热化学方程式____________________________________。
解析:(1)pH=12的Ba(OH)2溶液,c[Ba(OH)2]=0.005 mol/L,因此等体积的二者反应时,NaHSO4和Ba(OH)2的物质的量之比为2?1,发生反应的离子方程式:2H++SO+Ba2++2OH-===BaSO4↓+2H2O。(2)根据得失电子守恒配平该离子方程式。(3)1 mol乙醇燃烧时放出的热量为29.72 kJ×46=1367.12 kJ,因此乙醇燃烧的热化学方程式为:C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l);ΔH=-1367.12 kJ/mol。
答案:(1)2H++SO+Ba2++2OH-===BaSO4↓+2H2O
(2)1 6 14 2 3 7
(3)C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l);ΔH=-1367.12 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com