
题目列表(包括答案和解析)
21.(8分)有机物M、N中都只含有C、H、O三种元素,它们的分子结构如图所示。

已知N是M在浓硫酸存在下加热反应后的产物之一。M在浓硫酸存在条件下加热可得到一种遇FeCl3溶液显紫色的有机物A。试回答下列问题:
(1)有机物M的化学式为________。
(2)下列有关有机物M、N、A的说法不正确的是________(填字母)。
A.有机物N分子中含有羧基、碳碳双键、酚羟基、醇羟基等
B.有机物N能发生加成反应、酯化反应、消去反应、卤代反应
C.有机物N与有机物M互为同分异构体
D.有机物N能使溴的四氯化碳溶液褪色,也能使紫色石蕊试液变红色
E.有机物M、N、A都能发生缩聚反应形成高分子化合物
(3)有机物A有多种同分异构体,其中有一种同分异构体B的苯环上的一氯代物只有两种,B能发生水解反应,且1 mol B与足量NaOH溶液反应时,最多可消耗3 mol NaOH。则有机物B的结构简式为________。
(4)A能与有机物D在一定条件下反应生成一种相对分子质量为166的酯类物质。D可能的结构简式为________。
解析:根据C、H、O元素的成键原则可知,M分子结构中含有一个羧基、四个醇羟基、一个六元环,故M的化学式为C7H12O6,M在浓硫酸存在下脱水生成N,故N与M不是同分异构体;N分子结构中除含有羧基、醇羟基外,还含有碳碳双键,可发生加成反应、酯化反应、消去反应和卤代反应;A(138)+D―→酯(166)+H2O(18),M(D)=166+18-138=46,由于A中含有羧基和酚羟基,在一定条件下可以与醇发生酯化反应,也可以与羧酸发生酯化反应,故D为CH3CH2OH或HCOOH。B与A互为同分异构体,又能发生水解反应,则B为酯,又因其苯环上的一氯代物只有两种,则另一个羟基在对位,故B为
答案:(1)C7H12O6 (2)AC
(3) 
(4)CH3CH2OH或HCOOH
20.(10分)无机物A-J能发生如图所示的转化,其中A、B、C、D、G含有同一种元素,H是目前世界上用量最大的金属单质,E是气态单质,F可作磁性材料,J为红棕色固体。
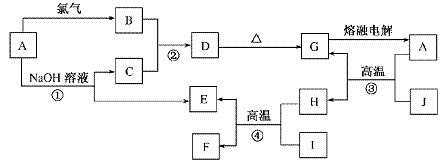
根据图示回答下列问题:
(1)写出下列物质的化学式:B________、G________。
(2)反应③叫做________反应,该反应原理可用在生产上,如________。
(3)反应④的化学方程式为_______________________。
(4)写出下列反应的离子方程式:①__________________________,②__________________________。
解析:由H是目前世界上用量最大的金属,可知H为Fe;F可作磁性材料,那么F为Fe3O4;J为红棕色固体,J为Fe2O3;Fe与I经反应④生成Fe3O4和E,则I为H2O,E为H2;A与J在高温条件下经反应③得到Fe,那么反应③为铝热反应,A是Al,该反应原理可用于冶炼钒、铬、锰等金属;电解熔融态的G生成Al,那么G为Al2O3。Al与Cl2反应生成B,那么B为AlCl3。Al与氢氧化钠溶液反应生成C和H2,那么C为NaAlO2溶液。NaAlO2溶液与AlCl3反应生成D,那么D为Al(OH)3。
答案:(1)AlCl3 Al2O3
(2)铝热 冶炼钒、铬、锰等金属
(3)3Fe+4H2O(g)Fe3O4+4H2
(4)①2Al+2OH-+2H2O===2AlO+3H2↑
②Al3++3AlO+6H2O===4Al(OH)3↓
19.(10分)X、Y、Z、W四种元素分别位于三个连续的短周期中,原子序数依次增大,其中Z与W同主族。X与Y可以形成化合物YX3和Y2X4。同时,X与Z可以形成化合物X2Z和X2Z2。请回答:
(1)X2Z2是________(填“极性”或“非极性”)分子。
(2)X、Y、Z、W元素可形成原子个数比为5:1:3:1的化合物,向其水溶液中加入少量NaOH溶液时,发生反应的离子方程式为__________________________________________。
(3)0.2 mol YX3气体在一定条件下的固定密闭容器中分解生成X2、Y2气体,达到平衡时,吸收热量a kJ,同一条件下,向相同体积的固定容器中加入0.1 mol Y2和0.3 mol X2,反应达到平衡时放出热量为b kJ,试写出X2和Y2反应的热化学方程式:_____________________________________________。
(4)有如图所示装置:该装置中Cu极为________极;当铜片的质量变化为3.2 g时,a极上消耗的Z2在标准状况下的体积为________ mL。Y2X4Z2燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成Y2和X2Z。则负极的电极反应式是____________________________________________________。

解析:由X、Y、Z、W分别位于三个连续的短周期中,原子序数依次增大,容易确定X为氢元素。Z与W同主族,确定Z为第二周期元素、W为第三周期元素,则Y也为第二周期元素。由YX3确定X为氮元素,由X2Z和X2Z2确定Z为氧元素,进而确定W为硫元素。(4)N2H4与氧气发生氧化还原反应,通入N2H4的一极为负极失去电子,通入氧气的一极为正极得到电子,铜电极作阳极,发生氧化反应。铜片质量减少3.2 g时,转移电子0.1 mol,整个电路中得失电子相等,因此参加反应的氧气为 mol,标准状况下的体积为 mol×22400 mL/mol=560 mL。
答案:(1)极性
(2)HSO+OH-===SO+H2O
(3)N2(g)+3H2(g)===2NH3(g)
ΔH=-10(a+b) kJ·mol-1
(4)阳 560 N2H4-4e-+4OH-===N2↑+4H2O
18.(9分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1 mol。
|
阳离子 |
K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
|
阴离子 |
OH- HCO CO Cl- NO SO |
若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化。
(1)溶液中________(填“一定”、“一定不”或“可能”)含有HCO或CO,理由是___________________________________。
(2)原溶液中所含的阴离子为________,阳离子为________。
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为_________________________________________。
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为________g。
解析:若向原溶液中加入足量的盐酸,有无色气体生成,且反应后溶液中阴离子种类没有变化,说明不可能含有碳酸根离子或碳酸氢根离子。可以推测无色气体由其他离子间反应生成,根据表中的离子种类可以推测只有Fe2+、NO在酸性条件下反应生成NO。加入盐酸阴离子种类没有改变,说明原溶液中含有Cl-,若只含有Cl-、NO两种阴离子,因为离子均为1 mol,利用电荷守恒分析,是不可能的,所以一定含有SO;再根据电荷守恒确定还有一种阳离子带两个单位电荷,可以确定只有Mg2+。灼烧后得到的固体是Fe2O3和MgO,根据守恒计算最终固体质量为120 g。
答案:(1)一定不 HCO与CO均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化
(2)Cl-、NO、SO Fe2+、Mg2+
(3)3Fe2++NO+4H+===3Fe3++NO↑+2H2O
(4)120
17.(8分)某研究性学习小组在查阅资料时发现:化工厂常用氨气来检验氯气是否泄漏。于是他们设计实验来探究氯气与氨气之间的反应。
制气实验装置有:(可重复选用)

实验药品有:a.MnO2(s) b.浓盐酸 c.浓氨水 d.KClO3(s) e.碱石灰 f.浓硫酸 g.饱和食盐水 h.NaOH(s) i.消石灰
请回答下列问题:
(1)利用上述实验装置与药品,实验室制备干燥氨气应选用的装置有________(填字母序号)。
(2)制取干燥氯气的装置由A、B、B组装而成,则B中应加装的试剂依次是________(填字母序号),A中反应的化学方程式为______________________________________________。
(3)为使氯气、氨气在如图所示装置中充分混合反应,则从a口进入的气体是________,若氨气量较多,瓶内会出现大量白烟,则该白烟为________。

(4)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,如果氯气过量,氯气与氨气反应生成两种化合物,一种产物分子的空间构型与NH3相似,该反应的化学方程式为__________________________________________。
答案:(1)A、C
(2)g、f KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
(3)氨气(NH3) 氯化铵(NH4Cl)
(4)3Cl2+NH3===NCl3+3HCl
16.取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化:

则转化过程中所加稀HNO3的物质的量浓度为( )
A.3.2 mol·L-1 B.3.6 mol·L-1
C.4.0 mol·L-1 D.4.4 mol·L-1
解析:固体混合物提供的氧与氢气结合使固体质量减少6.4 g,因此氧化亚铜和氧化铜的总物质的量为0.4 mol。生成一氧化氮4.48 L(标准状况下),即为0.2 mol,反应过程中转移电子0.6 mol,起氧化作用的硝酸为0.2 mol。设铜的物质的量为x、氧化亚铜的物质的量为y、氧化铜的物质的量为(0.4 mol-y),则参加反应的硝酸的物质的量为(x+y+0.4 mol)×2+0.2 mol。由电子守恒得2x+2y=0.6 mol,解得(x+y+0.4 mol)×2+0.2 mol=1.6 mol,c(HNO3)==3.2 mol·L-1。
答案:A
第Ⅱ卷(非选择题,共52分)
15.常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是( )
A.若a„b,则混合溶液的pH一定大于7
B.若a=2b,溶液呈酸性,则c(CH3COO-)>c(Na+)> c(CH3COOH)>c(H+)>c(OH-)
C.混合溶液中c(Na+)+c(H+)=c(OH-)+c(CH3COO-) 一定成立
D.混合溶液中c(CH3COO-)+c(CH3COOH)=a mol/L 一定成立
解析:若a≤b,则溶液的溶质是醋酸钠或醋酸钠和氢氧化钠,溶液呈碱性,A项正确;若a=2b,溶液中的溶质为等物质的量的醋酸钠和醋酸,溶液呈酸性,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),B项正确;C项是电荷守恒式,正确;两种溶液混合后,溶液体积发生变化,混合溶液的总体积不一定是1 L,D项错误。
答案:D
14.有关下图所示化合物的说法不正确的是( )

A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1 mol该化合物最多可以与3 mol NaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
解析:该有机物的官能团有酯基、羟基(酚类)、碳碳双键和醚键,显然A、B、C正确;该有机物能使FeCl3溶液显色,但无羧基,不能与NaHCO3溶液反应,D错。
答案:D
13.用下图所示实验装置进行实验(必要时可以进行加热)时,下列实验现象描述不正确的是( )

|
实验 |
试剂甲 |
试剂乙 |
试剂丙 |
丙中的现象 |
|
A |
H2O2 |
MnO2 |
FeCl2 |
溶液由浅绿色变为棕黄色 |
|
B |
浓氨水 |
CaO |
AgNO3 |
开始有白色沉淀生成,随后白色沉淀减少直至完全消失 |
|
C |
浓HNO3 |
Cu |
NaHCO3 |
有气泡生成 |
|
D |
H2SO4 |
Na2SO3 |
BaCl2 |
产生白色沉淀 |
解析:A选项,生成的氧气将FeCl2氧化为FeCl3;B选项,生成的氨气通入硝酸银溶液中,首先生成氢氧化银沉淀,然后氢氧化银溶解于氨水中;C选项浓硝酸与铜反应生成NO2,NO2溶于水生成硝酸,硝酸与NaHCO3反应生成二氧化碳;D选项,生成的二氧化硫不能与BaCl2溶液反应。
答案:D
12.中学所学的A、B、C三种物质都是由H、O、S、Na中的三种元素组成的强电解质,A、B的水溶液均呈碱性,测得pH相等的A、B溶液c(A)<c(B);C的水溶液呈酸性。有关说法正确的是( )
A.A是Na2SO3
B. B、C反应的离子方程式可能是:SO+2H+===SO2↑+H2O
C. B溶于溴水中,不可能生成沉淀
D. 若A、B两溶液的pH=9,则两溶液中水电离的OH-的物质的量浓度之比为1:1
解析:显碱性的物质可能是NaOH、Na2SO3、NaHS,pH相等的A、B溶液c(A)<c(B),说明A是NaOH,B是Na2SO3(或NaHS),C的水溶液显酸性且为强电解质,应为硫酸;若B为NaHS,与溴水发生反应(HS-+Br2===S↓+2Br-+H+)会生成S沉淀;A为NaOH,水电离的OH-与溶液中H+浓度相同,为10-9 mol/L,B为能水解的盐,溶液中的OH-全部由水电离,其浓度为109-14 mol/L,故二者之比为1?104。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com