
题目列表(包括答案和解析)
15. (8分)小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为________________________,
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为_________________________。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:


则操作①的名称为 ,试剂A的化学式为_________________________________。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是 (填化学式),产生该白色沉淀的离子方程式是____________________________________。
14. (10分)过氧化氢(H2O2)常被称为“绿色氧化剂”,它和水都是极弱的电解质,但它比水易电离。
(1)水电离生成H3O+和OH-叫做水的自偶电离,同水一样,过氧化氢也有极弱的自偶电离,其自偶电离的电离方程式为____________________________________________。
(2)由于H2O2显弱酸性,在一定条件下它能同强碱作用生成正盐或酸式盐,请写出H2O2与Ba(OH)2反应生成正盐的化学方程式:______________________________________。
(3)将双氧水加入经酸化的高锰酸钾溶液时,溶液的紫红色消褪了,此时双氧水表现
出 性。
若用HO2的双氧水与KMnO4(H+)反应,18O将存在 生成物里。
(4)长期使用劣质香粉,脸部可能因生成PbS而出现黑色斑点,已知PbS与下列各物质均能反应,欲除去黑色斑点,不宜选择 (填字母序号)。
A.H2O2溶液 B.KMnO4溶液 C.HNO3溶液
(5)将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲同学认为这是由于H2O2是弱酸,消耗了OH-而使红色褪去;乙同学则认为因H2O2具有氧化性,将酚酞氧化破坏其分子结构,红色消失,试设计一个实验,检验甲、乙两位同学谁的观点正确?____________________________________________________________________________。
13. (10分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是__________________________________________________________________________。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种: 。
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如下面流程图所示:
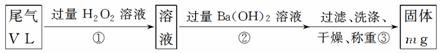

(4)写出步骤②中反应的化学方程式__________________________________________。
(5)步骤③中洗涤沉淀的方法是___________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为 (用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由:____________________________________。
12.硒(Se)是人体必需的一种微量元素,其单质可用于制光敏电阻、复印机的硒鼓等等。工业上提取硒的方法之一是用硫酸和硝酸钠处理含硒的工业废料,得到亚硒酸(H2SeO3)和少量硒酸(H2SeO4),富集后再将它们与盐酸共热,将H2SeO4转化为H2SeO3,主要反应为2HCl+H2SeO4===H2SeO3+H2O+Cl2↑,然后向溶液中通入SO2将硒元素还原为单质硒沉淀。据此正确的判断为 ( )
A.H2SeO4的氧化性比Cl2弱
B.SeO2的氧化性比SO2弱
C.H2SeO4的氧化性比H2SeO3强
D.浓H2SeO4的氧化性比HNO3强
11.实验室采购了部分化学药品。下图是从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是 ( )

硫酸
化学纯(CP):(500 mL) 品名:硫酸
化学式:H2SO4 相对分子质量:98
密度:1.84 g/cm3 质量分数:98%
A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Al与足量的该硫酸反应产生3 g氢气
C.“化学纯”是指这种硫酸只含H2SO4和H2O分子
D.配制200 mL 2.3 mol/L的稀硫酸需量取该硫酸25 mL
10.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl混合而成,为检验它的成分,做了如下实验:①将固体混合物溶于水,搅拌后得无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。则该固体混合物中 ( )
A.肯定有Na2SO4,可能有CuSO4
B.一定有NaCl,肯定没有Na2SO4
C.一定有Na2CO3,可能有NaCl
D.可能有CaCl2,一定没有CuSO4
9.下列叙述正确的是 ( )
A.氯水通入SO2后溶液的酸性减弱
B.向明矾溶液中加入过量NaOH溶液会产生大量白色沉淀
C.Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱
D.浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳
8.关于SO2的叙述中,正确的是 ( )
A.在有的反应中显示氧化性,有的反应中显示还原性
B.是酸性氧化物,溶于水得稳定的亚硫酸
C.SO2气体通入NaOH溶液中一定得到Na2SO3
D.SO2气体通入BaCl2溶液中,能生成白色沉淀
7.下列关于浓硫酸的叙述正确的是 ( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
6.对某酸性溶液(可能含有Br-,SO,H2SO3,NH)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是 ( )
A.Br- B.SO C.H2SO3 D.NH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com