
题目列表(包括答案和解析)
3.下列说法中正确的是 ( )
A.铁是人类在生产、生活中最早使用的金属材料
B.金、银、铜是应用最广泛的金属材料
C.钛被誉为“21世纪的金属”,应用前景很广阔
D.铜是导电性、导热性最好的有色金属
2.保利集团在香港拍卖会上花费3 000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和蛇首。普通铜器时间稍久容易出现铜绿,其主要成分是Cu2(OH)2CO3。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是 ( )
A.它们的表面都电镀上了一层耐腐蚀的黄金
B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
C.铜的金属活动性比氢弱,因此不易被氧化
D.它们是含一定比例金、银、锡、锌的铜合金
1.钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、耐腐蚀等,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切合实际的是 ( )
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于家庭装修,做钛合金装饰门
16. (1)Ca(OH)2或CaO Na2CO3 (2)溶解 过滤 蒸发 过滤 (3)有晶体析出(或出现浑浊) 碳酸钠溶解度比碳酸氢钠大 (4)NH4Cl 取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子 (5)NH+OH-NH3↑+H2O 防止加石灰水时产生碳酸钙沉淀
(6)w(NaHCO3)=×100%(m1为样品质量,m2为加热后剩余固体质量)
15. (1)ⅣA 最外层均有4个电子
(2)氢氟酸 SiO2+4HF===SiF4↑+2H2O
(3)①SiO2+Na2CO3Na2SiO3+CO2↑,
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓
②ABC (4)50%
14. (1)量筒、烧杯、玻璃棒
(2)Al2O3+6H+===2Al3++3H2O、Fe2O3+6H+===2Fe3++3H2O
(3)Fe(OH)3 取少量残渣2于小试管中,加入稀盐酸使其完全溶解,再加入KSCN溶液,溶液呈(血)红色
(4)蒸发浓缩,冷却结晶 Ca2+ (5)BD
13. (1)还原 氧化
(2)①Sn+2Cl2SnCl4
②Pb+Cl2PbCl2
③PbO2+4HCl(浓)PbCl2+Cl2↑+2H2O
11. B 12. B
16. (13分)(2010·上海,27)工业生产纯碱的工艺流程示意图如下:
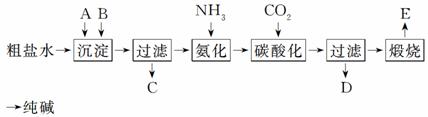

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:
A________,B__________。
(2)实验室提纯粗盐的实验操作依次为:
取样、________、沉淀、________、________、冷却结晶、________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是____________________________。
碳酸化时没有析出碳酸钠晶体,其原因是_____________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是__________(填写化学式),检验这一成分的阴离子的具体方法是______________________________________________________。
(5)氯碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为_________________________________________________。
滤液D加石灰水前先要加热,原因是__________________________________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为____________________________________________。
答案 1. B 2. B 3. D 4. C 5.C 6. C 7.C 8.C 9.D 10. B
15. (11分)含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________________________________________________________,
A与B在原子的电子层结构上的相同点是_________________________________。
(2)易与C发生化学反应的酸是__________,反应的化学方程式是__________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①分别写出生成D和F的化学反应方程式:_________________________________。
②要将纯碱高温熔化,下列坩埚中不可选用的是 ( )
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L, 100 g混合物中石灰石的质量分数是__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com