
题目列表(包括答案和解析)
14.(10分) A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
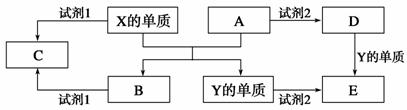
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是_________________________________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是__________________________。
13.(11分)铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为______________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________________________________________________________________________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是__________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁得到铁 |
Ⅰ对;Ⅱ对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可用作催化剂 |
Ⅰ错;Ⅱ对;无 |
|
D |
在空气中铁的表面能形成致密的氧化膜 |
铁不能与氧气反应 |
Ⅰ对;Ⅱ对;有 |
12.某同学设计下列方法对A盐的水解液进行鉴定:
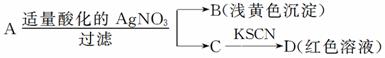

由此得出的结论中,不正确的是 ( )
A.D溶液中存在Fe(SCN)3
B.滤液中有Fe3+
C.B为AgBr
D.A一定为无氧酸盐FeBr2
11.将1.12 g铁粉加入25 mL 2 mol/L的氯化铁溶液中,充分反应后,其结果是 ( )
A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B.往溶液中滴入无色KSCN溶液,溶液变红色
C.Fe2+和Fe3+物质的量之比为5∶1
D.氧化产物和还原产物的物质的量之比为2∶5
10.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.向以物质的量1∶1混合的Cu、Fe2O3的混合物中加入过量的盐酸
B.以物质的量1∶2混合的(NH4)2SO4与BaCl2溶液
C.以物质的量2∶1混合的NaHCO3溶液与Na2O2固体
D.以物质的量2∶1混合的MgBr2和氯气反应后的产物
9.取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述正确的是 ( )
A.上述四种氧化物对应的水化物中,Al(OH)3酸性最强
B.向沉淀X中逐滴加入硝酸,沉淀慢慢溶解
C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
D.溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
8.某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO的物质的量浓度为6 mol/L,则此溶液最多可溶解铁粉的质量为 ( )
A.5.6 g B.11.2 g C.22.4 g D.33.6 g
7.某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO、CO、SO、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
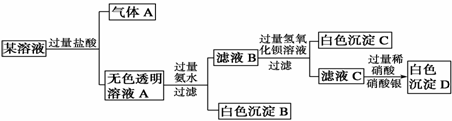
下列说法正确的是 ( )
A.原溶液中一定只存在AlO、CO、SO、Cl-四种离子
B.气体A的化学式是CO2,其电子式为

C.原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D.生成沉淀B的离子方程式为:Al3++3OH-===Al(OH)3↓
6.下列离子方程式中,正确的是 ( )
A.氧化亚铁和稀硝酸反应FeO+2H+===Fe2++H2O
B.铜和三氯化铁溶液反应Cu+Fe3+===Fe2++Cu2+
C.氯化亚铁溶液中滴入氯水Cl2+2Fe2+===2Cl-+2Fe3+
D.金属铝投入NaOH溶液中2Al+2OH-+H2O===2AlO+2H2↑
5.下列反应的离子方程式正确的是 ( )
A.硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-===Fe(OH)3↓
B.硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-===Fe2S3
C.过量的铁与很稀的硝酸溶液反应无气体放出:4Fe+10H++NO===4Fe2++3H2O+NH
D.硫化氢气体通入氯化亚铁溶液:H2S+Fe2+===FeS↓+2H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com