
题目列表(包括答案和解析)
8.(2011福建高考24,14分)
四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
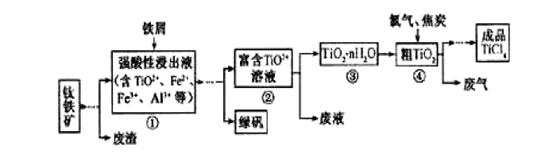
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+ Fe3+ +H2O的平衡常数K=_____________。
Fe3+ +H2O的平衡常数K=_____________。
(4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=-221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
|
|
TiCl4 |
SiCl4 |
|
熔点/℃ |
-25.0 |
-68.8 |
|
沸点/℃ |
136.4 |
57.6 |
解析:(1)根据题意给出方程式分析铁屑的作用就是作为还原剂的,即:将Fe3+还原为Fe2+,另外浸出液显紫色,说明含有Ti3+,防止Ti3+被Fe3+氧化成TiO2+。参考答案中“生成Ti3+保护Fe2+不被氧化。”有点让人费解,能不能说成“防止Ti3+被Fe3+氧化成TiO2+”或者说“将TiO2+还原成Ti3+”。
(2)形成TiO2·n H2O溶胶,说明得到是胶体,其分散质颗粒直径大小为10-9-10-7m(或1nm-100nm);
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,25℃时,c(H+)×c(OH-)=Kw=1×10-14;反应Fe (OH)3+3H+ Fe3+ +H2O的平衡常数K=
Fe3+ +H2O的平衡常数K=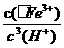 =
=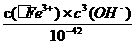 =
=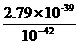 =2.79×103。
=2.79×103。
此问设计精妙!利用数学关系巧妙代换求出反应的平衡常数,命题者的独具匠心可见一斑。
(4)涉及盖斯定律计算,比较常规,按要求写出方程式相加即可得出答案:
TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=-81KJ·mol-1
(5)依据绿色化学理念,该工艺流程中存在的不足之处产生了废气,废液,废渣等。
(6)下表信息可以看出,SiCl4、TiCl4两者的沸点相差较大,要精制含少量SiCl4杂质的TiCl4可用蒸馏(或分馏)等方法。
这题是典型的化工流程题,问题设置不难。第(3)小问是亮点,精妙!个人觉得加上请计算该反应的平衡常数K可能设问更清晰。
答案:(1)使Fe3+还原为Fe2+;生成Ti3+保护Fe2+不被氧化。
(2)10-9m-10-7m(或其他合理答案);
(3)2.79×103;
(4)TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=-81KJ·mol-1;
(5)产生三废(或其他合理答案);
(6)蒸馏(或分馏,或精馏)。
7.(2011上海8)高炉炼铁过程中既被氧化又被还原的元素是
A.铁 B.氮 C.氧 D.碳
解析:本题考察炼铁原理。
答案:D
6.(2011上海5)高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
解析:高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质。
答案:A
5.(2011重庆) 下列叙述正确的是
A. Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性
C. Li、Na、K的原子半价和密度随原子序数的增加而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强
解析:铁属于变价属于变价金属,与强氧化剂反应生成Fe3+,与弱氧化剂反应生成Fe2+,氯气属于强氧化剂,盐酸属于非氧化性酸,因此选项A不正确;当硫酸不足时,Zn和K均过量,但过量的K会继续和水反应生成KOH而呈碱性,B不正确;同主族元素自上而下,随着核电荷数的增加电子层数逐渐增多,原子半径逐渐增大,密度也逐渐增大,但Na的密度大于K的,C不正确;C、P、S、Cl的非金属性逐渐增强,所以其最高价氧化物对应水化物的酸性逐渐增强,D正确。
答案:D
4.(2011山东高考12)Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、Fe Cl3、CuCl2均不能采用将溶液直接蒸干的方法
Cl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al
解析:铝对应的氧化物Al2O3属于两性氧化物,A不正确;铝属于活泼金属其表面易被空气中氧气氧化形成一层致密的氧化膜而使铝不易被腐蚀;铁放置在空气可以直接发生化学腐蚀,例如铁与氯气直接反应而被腐蚀;铜放置在空气中会和空气中氧气、二氧化碳和水缓慢的反应生成碱式碳酸铜即铜绿,方程式为2Cu+O2+CO2+H2O==Cu2(OH)2CO3,因此选项B不正确;AlCl3、Fe Cl3、CuCl2均属于强酸弱碱盐,在溶液中会水解生成相应的氢氧化物和HCl,溶液在加热时会促进水解,同时生成的HCl挥发,进一步促进水解,当溶液蒸干后将最终将得到相应的氢氧化物,所以选项C正确;铝属于活泼的金属元素,在水溶液中Al3+不会放电生成铝单质;Fe3+在水溶液会放电但产物是Fe2+,而不是单质铁;只有Cu2+在阴极上得到电子生成单质铜。所以选项D也不正确。
Cl3、CuCl2均属于强酸弱碱盐,在溶液中会水解生成相应的氢氧化物和HCl,溶液在加热时会促进水解,同时生成的HCl挥发,进一步促进水解,当溶液蒸干后将最终将得到相应的氢氧化物,所以选项C正确;铝属于活泼的金属元素,在水溶液中Al3+不会放电生成铝单质;Fe3+在水溶液会放电但产物是Fe2+,而不是单质铁;只有Cu2+在阴极上得到电子生成单质铜。所以选项D也不正确。
答案:C
3.(2011广东高考10)某同学通过系列实验探究Mg及其化合物的性质, 操作正确且能达到目的的是
操作正确且能达到目的的是
A、将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
B、将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C 、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D、将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
解析:本题考察镁及其化合物的性质、常见的基本实验操作。稀释浓硫酸时,应将浓硫酸沿着器壁慢慢加入水中,并及时搅拌,A是错误的;过滤时需要用玻璃棒引流,因此C不正确;蒸发溶液时应该用蒸发皿而不是表面皿,由MgCl2水解,所以加热时必需在HCl的气氛中加热才能得到MgCl2固体,所以D不正确。因此只有选项B是正确的。
答案:B
2.(2011福建高考9)下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
|
选项 化合物 |
A |
B |
C |
D |
|
Y |
CO2 |
Fe2O3 |
C2H5OH |
FeCl3 |
|
W |
MgO |
Al2O3 |
C2H5ONa |
CuCl2 |
解析:A项中是Mg与CO2反应,方程式为2Mg+2CO2 2MgO+C;B项中Al与Fe2O3发生铝热反应,方程式为Fe2O3+2Al
2MgO+C;B项中Al与Fe2O3发生铝热反应,方程式为Fe2O3+2Al 2Fe+Al2O3;C项中是金属Na与C2H5OH反应,方程式为2Na+2CH3CH2OH=2CH3CH2ONa+H2↑。这三个反应都是置换反应。D项中是发生Cu+2FeCl3=CuCl2+2FeCl2,不是置换反应,但学生可能将此反应记错,认为生成了铁单质。此题难度不大,但素材来自教学一线,考查学生平时学习的错误,对实际教学有一定的指导作用。
2Fe+Al2O3;C项中是金属Na与C2H5OH反应,方程式为2Na+2CH3CH2OH=2CH3CH2ONa+H2↑。这三个反应都是置换反应。D项中是发生Cu+2FeCl3=CuCl2+2FeCl2,不是置换反应,但学生可能将此反应记错,认为生成了铁单质。此题难度不大,但素材来自教学一线,考查学生平时学习的错误,对实际教学有一定的指导作用。
答案:D
1.(2011北京高考11)下列实验方案中,不能测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,建中b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
解析:NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3质量分数,A正确;Na2CO3和NaHCO3均可与盐酸反应生成水、二氧化碳和氯化钠,所以bg固体是氯化钠,利用守恒法可计算出Na2CO3质量分数,B正确;混合物与足量稀硫酸充分反应,也会生成水和二氧化,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,因此选项C不能测出混合物中Na2CO3质量分数;Na2CO3和NaHCO3都与Ba(OH)2反应,反应的方程式为
CO32-+Ba2+=BaCO3↓、HCO3-+OH-+Ba2+=H2O+BaCO3↓,因此最后得到的固体是BaCO3,所以可以计算出Na2CO3质量分数,选项D也正确。
答案:C
26.(2011上海27)CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
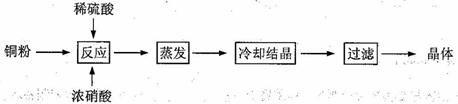
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、
。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是 ,除去这种杂质的实验操作称为 。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4·5H2O g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
在滴定中,准确读数应该是滴定管上蓝线 所对应的刻度。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
① ②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是
(6)如果1.040 g提纯后的试样中含CuSO4·5H2O的准确值为1.015 g,而实验测定结果是l.000 g 测定的相对误差为 。
解析:本题主要考察实验现象等观察、物质的提纯,中和滴定、实验过程设计及有关计算。
答案:(1)溶液呈蓝色,有红棕色气体生成
(2)Cu(NO3)2 重结晶
(3)0.0980
(4)标准盐酸溶液润洗2-3次 粗细交界点
(5)称取样品 在上层清液中继续滴加加氯化钡溶液,观察有无沉淀产生
(6)-1.5%(-1.48%)
25.(2011四川,16分)
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1) 铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
② 加入锌粉的目的是________。
③ 写出步骤三中发生反应的离子方程式________。
④ 实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2) 结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_____ ____。
分析:本题主要考察一定物质的量浓度的配制、中和滴定、误差分析、实验操作及有关计算。
答案:(1)①溶解 定容
②将Fe3+还原成Fe2+
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
④11.20%或0.112 偏高
(2)加热后在干燥器中冷却,对盛有样品的坩埚进行多次加热,干燥器中冷却、称量并记录质量,直至称量质量几乎相等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com