
题目列表(包括答案和解析)
8.(2011海南)一种充电电池放电时的电极反应为
H2+2OH--2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH-
当 为电池充电时,与外电源正极连接的电极上发生的反应是
为电池充电时,与外电源正极连接的电极上发生的反应是
A. H2O的还原 B. NiO(OH)的还原
C. H2的氧化 D. NiO(OH) 2的氧化
[答案]D
命题立意:考查二次电池中的氧化还原问题
解析:由题中给出的电极反应可判断出做原电池时,H2是还原剂被氧化、NiO(OH)是氧化剂被还原,则充电时H2是还原产物、NiO(OH)是氧化产物,与正极相连的是阳极发生氧化反应,所以“NiO(OH) 2的氧化”正确。
[技巧点拨]关于充电电池的氧化还原问题是常考点,这类题有规律。原电池时,先要分析氧化剂与还原剂,氧化剂被还原、还原剂被氧化;充电时(电解池),原电池负极反应反着写为还原过程,发生在阴极,原电池中的正极反应反着写为氧化过程,发生在阳极。
7.(2011新课标全国)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
解析:由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,因此选项AB均正确;充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH--2e-= Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-= Fe+2OH-,因此电池充电过程中,阴极附近溶液的pH会升高,C不正确;同理分析选项D正确。
答案:C
6.(2011山东高考15)以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后对铁制品失去保护作用
解析:电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。因此在铁制品上镀锌时,铁作阴极,锌作阳极,由于锌比铁活泼,因此未通电前可以构成原电池,但此时锌作负极失去电子,铁作正极,而电镀是锌仍然失电子,所以选项A不正确;在氧化还原反应中必需满足得失电子守恒,因此电镀时通过的电量与锌的析出量有确定关系而与能量变化无关,B不正确;由于电镀时保持电流恒定,因此导线中通过的电子速率是不变的,所以升高温度不能改变电解反应速率,C正确;镀锌层破损后,由于锌比铁活泼,所以即使发生电化学腐蚀也是锌失去电子而保护了铁,即选项D也不正确。
答案:C
5.(2011广东高考12)某小组为研究电化学原理,设计如图2装置。下列叙述不正确的是
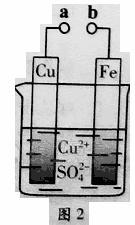
A、a和b不连接时,铁片上会有金属铜析出
B、a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D、a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
解析:本题考察原电池、电解池的原理、判断及其应用。若a和b不连接,则不能构成原电池,单质铁直接与Cu2+发生氧化还原反应而置换出铜,方程式为:Fe+Cu2+=Fe2++Cu,A正确;若a和b用导线连接,则构成原电池,此时铁作负极,铜作正极,方程式分别为:Fe-2e-=Fe2+、Cu2++2e-= Cu,B正确;有A、B分析可知,选项C是正确的;若a和b分别连接直流电源正、负极,则构成电解池,此时铜作阳极失去电子被氧化,铁作阴极,在电解池中阳离子向阴极运动,因此选项D是错误的。
答案:D
4.(2011福建高考11)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O=== 2LiOH+H2↑
解析:考生可能迅速选出C项是错误,因为原电池放电时OH-是向负极移动的。这个考点在备考时训练多次。这种电池名称叫锂水电池。可推测其总反应为:2Li+2H2O=== 2LiOH+H2↑。再写出其电极反应如下:
(-)2Li-2e-=2Li+
(+)2H2O+2e-=2OH-+H2↑
结合选项分析A、B、D都是正确的。
此题情景是取材于新的化学电源,知识落脚点是基础,对原电池原理掌握的学生来说是比较容易的。
答案:C
3.(2011北京高考8)结合下图判断,下列叙述正确的是
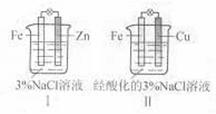
A.Ⅰ和Ⅱ中正极均被保护
B. Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C. Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D. Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
解析:锌比铁活泼,装置Ⅰ中锌作负极,方程式为Zn-2e-=Zn2+。铁作正极,但溶液显中性,所以发生锌的吸氧腐蚀,正极反应是O2+2H2O+4e-=4OH-;铁比铜活泼,装置Ⅱ中铁作负极,负极反应为Fe-2e-=Fe2+。铜作正极,但溶液显酸性,所以正极是溶液中的氢离子得电子,方程式为2H++2e-=H2↑。因为装置Ⅰ中没有Fe2+生成,所以装置Ⅰ中加入少量K3Fe(CN)6溶液时,没有蓝色沉淀产生。综上所叙,只有选项A是正确的。
答案:A
2.(2011安徽高考12)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D. AgCl是还原产物
解析:由电池总反应可知银失去电子被氧化得氧化产物,即银做负极,产物AgCl是氧化产物,A、D都不正确;在原电池中阳离子在正极得电子发生还原反应,所以阳离子向电池的正极移动,C错误;化合物Na2Mn5O10中Mn元素的化合价是+18/5价,所以每生成1 mol Na2Mn5O10转移电子的物质的量为(4-18/5)×5=2mol,因此选项B正确。
答案:B
1.(2011浙江高考10)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
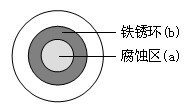
A.液滴中的Cl―由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+
Cu2+
解析:液滴边缘O2多,在碳粒上发生正极反应O2+2H2O+4e- 4OH-。液滴下的Fe发生负极反应,Fe-2e-
4OH-。液滴下的Fe发生负极反应,Fe-2e- Fe2+,为腐蚀区(a)。
Fe2+,为腐蚀区(a)。
A.错误。Cl-由b区向a区迁移
B.正确。
C.错误。液滴下的Fe因发生氧化反应而被腐蚀。
D.错误。Cu更稳定,作正极,反应为O2+2H2O+4e- 4OH-。
4OH-。
答案:B
[评析]本题考察电化学内容中金属吸氧腐蚀的原理的分析。
老知识换新面孔,高考试题,万变不离其宗,关键的知识内容一定要让学生自己想懂,而不是死记硬背。学生把难点真正“消化”了就可以做到一通百通,题目再怎么变换形式,学生也能回答。
3.(2011上海24)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3-=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
解析:(1)根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1;(2)H2S是还原性气体可用碱液吸收或硫酸铜溶液吸收;(3)As2S3作还原剂,转移电子的个数是2×(5-3)+3×(0+2)=10。NO2属于还原产物,在正极生成;(4)根据电子守恒可知生成CO2的量是0.5mol×4/4=0.5mol,但考虑到随着反应到进行,硝酸的浓度会降低而稀硝酸不与碳反应。
答案:(1)1:1
(2)As2S3 氢氧化钠溶液或硫酸铜溶液
(3)10mol 正极
(4)a
2.(2011上海18)氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2F2+2H2O=4HF+O2 D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
解析:反应Br2+SO2+2H2O=H2SO4+2HBr中,水既非氧化剂又非还原剂。A中水既非氧化剂又非还原剂;B中水既非氧化剂又非还原剂;C中水还原剂;D中水作氧化剂。
答案:CD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com