
题目列表(包括答案和解析)
4.(2011福建高考10)常温下0.1mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A.将溶液稀释到原体积的10倍 B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸 D.提高溶液的温度
解析:醋酸是弱酸,电离方程式是CH3COOH H++CH3COO-,故稀释10倍,pH增加不到一个单位,A项错误;加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成(a+1);B项正确;加入等体积0.2 mol·L-1盐酸,虽然抑制醋酸的电离,但增大了c(H+),溶液的pH减少;C项错误;提高溶液的温度,促进了醋酸的电离,c(H+)增大,溶液的pH减少;D项错误。
H++CH3COO-,故稀释10倍,pH增加不到一个单位,A项错误;加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成(a+1);B项正确;加入等体积0.2 mol·L-1盐酸,虽然抑制醋酸的电离,但增大了c(H+),溶液的pH减少;C项错误;提高溶液的温度,促进了醋酸的电离,c(H+)增大,溶液的pH减少;D项错误。
此题涉及弱电解质的电离平衡移动,切入点都是比较常规的设问,但学生易错选。
答案:B
3.(2011浙江高考13)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
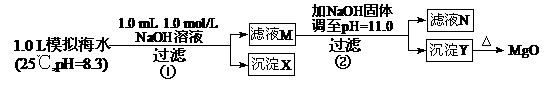
|
模拟海水中的离 子浓度(mol/L) |
Na+ |
Mg2+ |
Ca2+ |
Cl― |
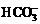 |
|
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
解析:步骤①发生Ca2++OH―+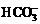
 CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。
CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。
A.正确。生成0001 mol CaCO3。
B.错误。剩余c(Ca2+)=0.001 mol/L。
C.错误。c(Mg2+)=5.6×10-6<10-5,无剩余,
D.错误。生成0.05 mol Mg(OH)2,余0.005 mol OH―,Q[Ca(OH)2]=0.01×0.0052=2.5×10-7<Ksp,无Ca(OH)2析出。
答案:A
[评析]本题考察方式很新颖,主要考察溶度积的计算和分析。解题时要能结合溶度积计算,分析推断沉淀是否产生,要求较高。
答案:BD
2.(2011安徽高考12)室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
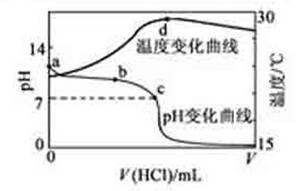
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)= c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
解析:氨水属于弱碱,因此在1.000mol·L-1氨水中OH-的浓度不会是1.000mol·L-1而是要小于1.000mol·L-1,由水得离子积常数可知溶液中H+浓度应大于1.0×10-14mol/L,A不正确;由图像可知b点溶液显碱性,说明此时氨水有剩余,即溶液是由氨水和氯化铵组成的,因此有c(NH4+)+c(NH3·H2O)>c(Cl-),B不正确;由图像可知c点溶液显中性,由电荷守衡可知c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以c(NH4+)=c(Cl-),C正确;由图像可知d点后溶液中主要物质是NH4Cl,而NH4Cl要水解吸热,所以温度会略有降低,D也不正确。
答案:C
1.(2011江苏高考14)下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:
c(CO32-)> c(HCO3-)> c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7, c(Na+)=0.1 mol·L-1]:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
继续:本题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,高三复习中要反复加强训练。
A.在0.1 mol·L-1NaHCO3溶液中,HCO3-在溶液中存在水解与电离两个过程,而溶液呈碱性,说明水解过程大于电离过程,c(H2CO3)>c(CO32-)
B.c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)中把c(H+)移项到等式另一边,即是质子守恒关系式。
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液后,相当于0.05 mol·L-1的Na2CO3溶液和NaHCO3溶液的混合液,由于Na2CO3的水解程度大于NaHCO3的水解程度,因此正确的关系是:c(HCO3-)>c(CO32-)> c(OH-)>c(H+)。
D.常温下,CH3COONa和CH3COOH混合溶液,包括CH3COO-水解和CH3COOH电离两个过程,既然pH=7, 根据电荷守恒式,不难得出c(Na+)=c(CH3COO-) =0.1 mol· L-1,c(H+)=c(OH-)=1×10-7 mol·L-1。水解是有限的,c(CH3COOH)>c(CH3COO-)。
14.(2011四川,14分)
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
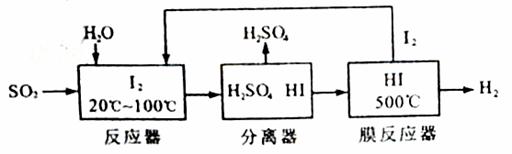
请回答下列问题:
(1)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______________。
(2)该循环工艺过程的总反应方程式为_____________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为____________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为____________
解析:本题主要考察热化学方程式的书写、勒夏特列原理的应用和电极反应方程式的书写。
答案:(1)4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol
(2)2H2O+SO2=H2SO4+H2
(3)减小氢气的浓度,使HI分解平衡正向移动,提供HI的分解率
(4)MH+OH--e-=M+H2O
2H2O+O2+4e-=4OH-
13.(2011北京高考26,14分)
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
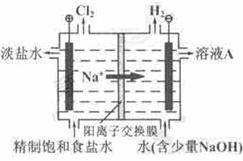
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2-3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来电解池):
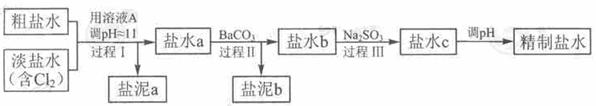
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3 盐水b ,至多添加10% Na2SO3溶液 kg(溶液体积变化忽略不计)。
解析:(1)电解时在电极的作用下,溶液中的阳离子向阴极作定向运动,阴离子向阳极作定向运动,所以电解饱和食盐水时Na+和H+向阴极运动并放电,但H+比Na+易得电子,所以H+首先放电,方程式为2H++2e-=H2↑。由于H+是水电离出的,所以随着H+的不断放电,就破坏了阴极周围水的电离平衡,OH-的浓度就逐渐增大,因此溶液A的溶质是NaOH。由于Cl-比OH-易失电子,所以在阳极上CI-首先放电,方程式为2Cl--2e-=Cl2↑。因此电解饱和食盐水的离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
(2)见解析(1)
(3)由于阳极上生成氯气,而氯气可溶于水,并发生下列反应Cl2+H2O HCl+HClO,根据平衡移动原理可知增大盐酸的浓度可使平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的溢出。
HCl+HClO,根据平衡移动原理可知增大盐酸的浓度可使平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的溢出。
(4)由于溶液中含有Mg2+,所以用溶液A(即NaOH)调节溶液的pH时,会产生Mg(OH)2沉淀,即盐泥a中还含有Mg(OH)2;淡盐水中含有氯气,氯气具有强氧化性,可将NH4+氧化为N2,而氯气被还原成Cl-,方程式为2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑;沉淀转化的实质就是沉淀溶解平衡的移动,一般说来,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。由于BaSO4的溶解度比BaCO3的小,所以加入BaCO3后,溶液中的SO42-就结合Ba2+生成更难溶的BaSO4沉淀,同时溶液中还存在Ca2+而CaCO3也属于难溶性物质,因此还会生成CaCO3沉淀;NaClO具有强氧化性,可将Na2SO3氧化成Na2SO4,方程式为Na2SO3+NaClO=Na2SO4+NaCl。10m3 盐水b中含NaClO的物质的量为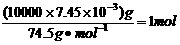 ,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有
,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有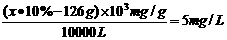 ,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。
,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。
答案:(1)NaOH
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
(4)①Mg(OH)2
②2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑
③SO42-、Ca2+
④1.76
12.( 2011江苏高考13,12分) Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3 溶液,生成Ag2O沉淀,保持反应温度为80℃,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+K2SO4+2H2O
Ag2O2↓+2KNO3+K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是
。
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为
K2Zn(OH)4,写出该电池反应方程式: 。
(3)准确称取上述制备的样品(设Ag2O2仅含和Ag2O)2.558g,在一定的条件下完全分解为Ag 和O2 ,得到224.0mLO2(标准状况下)。计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位)。
解析:本题以银锌碱性电池正极活性物质Ag2O2制备、制备过程检验洗洗涤是否完全的实验方法、电池反应、以及成分分析与相关计算为背景,试图引导学生关注化学与社会生活,考查学生用化学的思维方式来解决一些现实生活中的一些具体问题的能力。
[备考提示]高三复习重视化学与社会生活问题联系,要拓展搞活学科知识。化学计算要物质的量为基本,适当关注化学学科思想(如质量守恒、电荷守恒、极端分析等)等在化学计算中的运用。
答案:(1)取少许最后一次洗涤滤液,滴入1-2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1-2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
(2)Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag
(3)n(O2)=224mL/22.4L·mL-1·1000mL· L-1=1.000×10-2 mol
设样品中Ag2O2的物质的量为x, Ag2O的物质的量量为y
248g·mol-1 × x + 232 g·mol-1 × y =2.588 g
x+1/2 y =1.000×10-2 mol
x=9.500×10-3 mol
y=1.000×10-3 mol
w(Ag2O2)=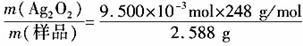 =0.91。
=0.91。
11.(2011上海)用电解法提取氯化铜废液中的铜,方案正确的是
A.用铜片连接电源的正极,另一电极用铂片 B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物 D.用带火星的木条检验阳极产物
解析:用电解法提取氯化铜废液中的铜时,铜必需作阴极,阳极是铜或惰性电极,阴极的反应式为:Cu2++2e-=Cu。
答案:B
10.(2011全国II卷10)用石墨做电极电解CuSO4溶液。通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
解析:用石墨做电极电解CuSO4溶液的电解方程式是2CuSO4+2H2O 2H2SO4+2Cu+O2↑,根据缺什么补什么的,选项C正确。
2H2SO4+2Cu+O2↑,根据缺什么补什么的,选项C正确。
答案:C
9.(2011海南)根据下图,下列判断中正确的是
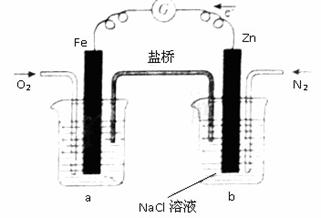
A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e -=H2
-=H2
D.烧杯b中发生的反应为2Cl--2e-=Cl2
[答案]AB
命题立意:原电池相关知识的考查
解析:题中给出的物质表明,该电池的总反应是2Zn + O2 + 2H2O = 2Zn(OH)2,a烧杯中电极反应为O2 + 2H2O +4e- =4OH-, b中Zn-2e- = Zn2+,所以正确项为AB。
[技巧点拨]原电池的题是历届常考点,本题可视为由前年高考中的铝空电池变化而来。主要是先要找到电池的总反应,反应中各电极反应、电极周围酸碱性变化、离子浓度变化及计算才能有据可依。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com