
题目列表(包括答案和解析)
14.(2011四川)25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1:10:10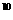 :10
:10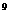 B.1:5:5×10
B.1:5:5×10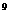 :5×10
:5×10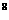
C.1:20:10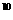 :10
:10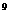 D.1:10:10
D.1:10:10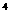 :10
:10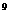
解析:酸或碱是抑制水电离的,且酸性越强或碱性越强,抑制的程度就越大;能发生水解的盐是促进水电离的。由题意知①②③④中发生电离的水的物质的量分别是10-14、10-13、10-4、10-5,所以选项A正确。
答案:A
13.(2011全国II卷9)温室时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
A.若PH>7时,则一定是c1v1=c2v2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若V1=V2,则一定是c2>c1
D.若V1=V2,C1=C2,则c(CH3COO-)+C(CH3COOH)=C(Na+)
解析:若c1v1=c2v2说明二者恰好反应生成醋酸钠,醋酸钠水解显碱性,但NaOH过量时液也显碱性。
答案:A
12.(2011全国II卷6)等浓度的系列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的PH由小到大排列的正确是
A.④②③① B.③①②④ C.①②③④ D.①③②④
解析:乙酸、碳酸和苯酚的酸性依次降低,故PH依次增大。乙醇属于非电解质,PH最大。
答案:D
11.(2011海南)用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为

A. 22.30mL B. 22.35mL C. 23.65mL D. 23.70Ml
[答案]B
命题立意:考查基本的实验素质,滴定管读数。
解析:图中液面在22~23mL之间,分刻度有10个,因而每刻度是0.1mL,液体的凹面读数约为22.35mL。
[误区警示]:本题是基础题,但要注意读数时滴定管与量筒间的差别,滴定管是由上向下读数,量筒则正好相反。
10.(2011新课标全国)将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A. c(H+)
B. 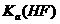 C.
C. 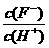 D.
D.
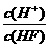
解析:HF属于弱电解质,加水促进HF的电离平衡向右移动,即电离程度增大,但电离平衡常数只与温度有关,所以选项B不变;但同时溶液的体积也增大,所以溶液的酸性会降低,即c(H+)、c(F-)和c(HF)的浓度均降低,考虑到溶液中水还会电离出氢离子,所以稀释到一定程度(即无限稀释时),c(H+)就不在发生变化,但c(F-)和c(HF)却一直会降低,所以选项D符合题意。
答案:D
9.(2011重庆) 对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热 B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体 D.小苏打溶液中加入少量NaCl固体
解析:本题考察外界条件对盐类水解及电离平衡的影响。盐类水解是吸热的,因此加热有利于水解反应向正方应方向移动,明矾中的Al3+水解,方程式为Al3++3H2O Al(OH)3+3H+,加热时酸性会增强,A不正确;CH3COONa水解显碱性,方程式为CH3COO-+H2O
Al(OH)3+3H+,加热时酸性会增强,A不正确;CH3COONa水解显碱性,方程式为CH3COO-+H2O CH3COOH+OH-,加热时碱性会增强,所以溶液颜色会变深,B正确;氨水显碱性,溶液中存在下列电离平衡NH3·H2O
CH3COOH+OH-,加热时碱性会增强,所以溶液颜色会变深,B正确;氨水显碱性,溶液中存在下列电离平衡NH3·H2O NH4++OH-,加入少量NH4Cl固体,会增大NH4+的浓度,抑制氨水的电离,从而降低碱性,颜色会变浅,C不正确;NaHCO3属于强电解质,电离方程式为NaHCO3=Na++HCO3-,HCO3-同时电离和水解平衡,方程式为HCO3-
NH4++OH-,加入少量NH4Cl固体,会增大NH4+的浓度,抑制氨水的电离,从而降低碱性,颜色会变浅,C不正确;NaHCO3属于强电解质,电离方程式为NaHCO3=Na++HCO3-,HCO3-同时电离和水解平衡,方程式为HCO3- H++CO32-,HCO3-+H2O
H++CO32-,HCO3-+H2O H2CO3+OH-。由于水解程度大于电离程度,所以NaHCO3溶液显弱碱性,但加入少量NaCl固体时,对两个平衡不会产生影响,即颜色不发生变化,D不正确。
H2CO3+OH-。由于水解程度大于电离程度,所以NaHCO3溶液显弱碱性,但加入少量NaCl固体时,对两个平衡不会产生影响,即颜色不发生变化,D不正确。
答案:B
8.(2011天津)下列说法正确的是
A.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-
C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
解析:在稀溶液中水的离子积常数KW=c(H+)·c(OH-),KW只与温度有关而与溶液的酸碱性无关,由于水的电离是吸热的,因此温度升高时会促进水的电离,即KW会增大,例如25℃时KW=1×10-14,而在100℃时KW=1×10-12,所以选项A不正确;碘水具有氧化性,可以将二氧化硫氧化成硫酸,而单质碘被还原成碘离子,方程式为SO2+I2+2H2O=SO42-+2I-+4H+,选项B不正确;能和铝粉反应产生氢气的溶液既可以显酸性也可以显碱性,这四种离子:Na+、Ba2+、AlO2-、NO3-虽然在酸性溶液中不能大量共存(AlO2-会结合H+,生成氢氧化铝沉淀或生成Al3+),但可以在碱性溶液中大量共存,因此选项C正确;100℃时,KW=1×10-12,此时pH=2的盐酸其浓度为10-2mol/L,但pH=12的NaOH溶液其其浓度为1mol/L,所以当二者等体积混合时NaOH过量,溶液显碱性,D不正确。
答案:C
7.(2011天津)25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)
B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-)
C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)
D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+)
解析:pH>7时,c(H+)不可能大于c(OH-)的,所以选项A明显不正确;由溶液中的电荷守恒定律知:c(K+)+c(H+)=c(C6H5O-)+c(OH-),所以不可能满足c(K+)>c(C6H5O-)>c(H+)>c(OH-),即选项B不正确;中苯酚是一种极弱的酸,所以当KOH溶液和苯酚恰好反应,产物苯酚钾会发生水解反应而显碱性。由题中数据不难计算出,当二者恰好反应时消耗苯酚的体积是10ml,此时溶液中粒子的浓度大小关系为:
c(K+)>c(C6H5O-)>c(OH-)>c(H+),所以选项C是不正确的;当加入苯酚的体积是20ml时,苯酚过量,溶液是由等物质的量浓度的苯酚和苯酚钾组成,所以根据物料守恒可知c(C6H5O-)+c(C6H5OH)=2c(K+)一定成立,因此选项D是正确的。
答案:D
6.(2011山东高考14)室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中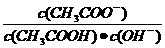 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mlpH=11的NaOH溶液,混合液pH=7
解析:醋酸属于弱酸,加水稀释有利于醋酸的电离,所以醋酸的电离程度增大,同时溶液中导电粒子的数目会增大,由于溶液体积变化更大,所以溶液的酸性会降低,即c(H+)、c(CH3COO-)、c(CH3COOH)均会降低,因此选项A、C均不正确;由水的离子积常数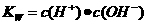 知
知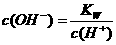 ,所以
,所以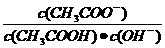 =
=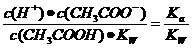 其中
其中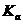 表示醋酸的电离平衡常数,由于水的离子积常数和醋酸的电离平衡常数均只与温度有关,所以选项B正确;pH=3的醋酸说明醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液说明氢氧化钠的浓度等于0.001mol/L,因为在稀释过程中醋酸的物质的量是不变的,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,因此溶液显酸性,D不正确。
表示醋酸的电离平衡常数,由于水的离子积常数和醋酸的电离平衡常数均只与温度有关,所以选项B正确;pH=3的醋酸说明醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液说明氢氧化钠的浓度等于0.001mol/L,因为在稀释过程中醋酸的物质的量是不变的,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,因此溶液显酸性,D不正确。
答案:B
5.(2011广东非公开11)对于0.1mol•L- 1
Na2SO3溶液,正确的是
1
Na2SO3溶液,正确的是
A、升高温度,溶液的pH降低
B、c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
C、c(Na+)+c(H+)=2 c(SO32―)+ 2c(HSO3―)+ c(OH―)
D、加入少量NaOH固体,c(SO32―)与c(Na+)均增大
解析:本题考察盐类水解及外界条件对水解平衡的影响和溶液中离子浓度大小判断。Na2SO3属于强碱弱酸盐,水解显碱性,方程式为SO32-+H2O HSO3-+OH-、HSO3-+H2O
HSO3-+OH-、HSO3-+H2O H2SO3+OH-,因为水解是吸热的,所以升高温度,有利于水解,碱性会增强,A不正确;加入少量NaOH固体,c(OH―)增大,抑制水解,所以c(SO32―)增大,D是正确的;由物料守恒知钠原子个数是硫原子的2倍,因此有c(Na+)=2c(SO32―)+2 c(HSO3―)+ 2c(H2SO3),所以B不正确,有电荷守恒知c(Na+)+c(H+)=2 c(SO32―)+ c(HSO3―)+ c(OH―),因此C也不正确。
H2SO3+OH-,因为水解是吸热的,所以升高温度,有利于水解,碱性会增强,A不正确;加入少量NaOH固体,c(OH―)增大,抑制水解,所以c(SO32―)增大,D是正确的;由物料守恒知钠原子个数是硫原子的2倍,因此有c(Na+)=2c(SO32―)+2 c(HSO3―)+ 2c(H2SO3),所以B不正确,有电荷守恒知c(Na+)+c(H+)=2 c(SO32―)+ c(HSO3―)+ c(OH―),因此C也不正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com