
题目列表(包括答案和解析)
7.(201上海17)120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.2.0mol/L B.1.5 mol/L C.0.18 mol/L D.0.24mol/L
解析:若碳酸钠恰好与盐酸反应生成碳酸氢钠,则盐酸的浓度是1.0 mol/L;若碳酸钠恰好与盐酸反应生成二氧化碳,则盐酸的浓度是2.0 mol/L。由于最终生成的气体体积不同,所以只能是介于二者之间。
答案:B
6.(2011上海7)下列溶液中通入SO2一定不会产生沉淀的是
A. Ba(OH)2 B. Ba(NO3)2 C. Na2S D. BaCl2
解析:A生成BaSO3沉淀;SO2溶于水显酸性,被Ba(NO3)2氧化生成硫酸,进而生成BaSO4沉淀;SO2通入Na2S溶液中会生成单质S沉淀。
答案:D
5.(2011上海6)浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
A.酸性 B.脱水性 C.强氧化性 D.吸水性
解析:浓硫酸具有吸水性、脱水性和强氧化性。在与含有水分的蔗糖作用过程中不会显示酸性。
答案:A
4.(2011海南)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
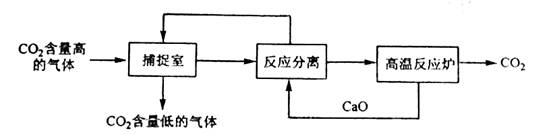
下列有关该方法的叙述中正确的是
A.能耗大是该方法的一大缺点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
[答案]AD
解析:由题可知基本过程中有两个反应:①二氧化碳与氢氧化钠反应,②碳酸钙的高温分解。A选项正确,循环利用的应该有CaO和NaOH 两种物质,B选项错误;“反应分离”过程中分离物质的操作应该是过滤,C选项错误;D选项中甲醇工业上可用CO2制备。
[技巧点拨]根据题中信息可知,捕捉室中反应为二氧化碳与氢氧化钠反应,得到的Na2CO3和CaO在溶液中反应得到NaOH和CaCO3,由此可分析出各选项正误。
3.(2011山东高考10)某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中只以化合态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定
解析:依据原子核外电子的排布规律可知,在短周期元素中原子核外最外层电子数是次外层电子数的一半的元素可以是Li或Si元素,但Li属于金属不符合题意,因此该元素是Si元素。硅是一种亲氧元素,在自然界它总是与氧相化合的,因此在自然界中硅主要以熔点很高的氧化物及硅酸盐的形式存在,选项A正确;硅位于金属和非金属的分界线附件常用作半导体材料,二氧化硅才用作光导纤维,选项B不正确;硅的最高价氧化物是二氧化硅,SiO2与酸不反应但氢氟酸例外,与氢氟酸反应生成SiF4和水,因此氢氟酸不能保存在玻璃瓶中,选项C不正确;硅和碳都属于ⅣA,但硅位于碳的下一周期,非金属性比碳的弱,因此其气态氢化物的稳定性比甲烷弱,选项D也不正确。
答案:A
2.(2011江苏高考9)NaCl是一种化工原料,可以制备一系列物质(见图4)。下列说法正确的是
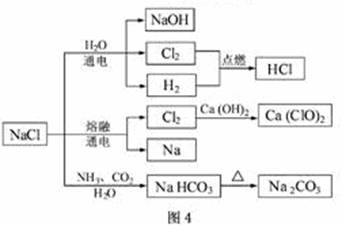
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
解析:本题考查元素化合物知识综合内容,拓展延伸至电解饱和食盐水、电解熔融氯化钠、侯氏制碱等内容,但落点很低,仅考查NaHCO3 、Na2CO3的溶解度、工业制漂白粉、干燥的Cl2贮存和基本反应类型。重基础、重生产实际应该是我们高三复习也应牢记的内容。25℃,NaHCO3在水中的溶解度比Na2CO3的要小;石灰乳与Cl2的反应中氯发生歧化反应,Cl2既是氧化剂,又是还原剂;常温下干燥的Cl2能用钢瓶贮存仅代表常温Cl2不与铁反应,加热、高温时可以反应;在侯氏制碱法中不涉及氧化还原反应。
答案:B
1.(2011江苏高考3)下列有关物质的性质和该性质的应用均正确的是
A.常温下浓硫酸能是铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
解析:本题属于元素及其化合物知识的考查范畴,这些内容都来源于必修一、选修四和必修二等课本内容。看来高三一轮复习一定注意要抓课本、抓基础,不能急功近利。
二氧化硅不与任何酸反应,但可与氢氟酸反应。二氧化氯中氯的化合价为+4价,不稳定,易转变为-1价,从而体现氧化性。铜的金属活泼性比铁差,在原电池中作正极,海轮外壳上装铜块会加快海轮外壳腐蚀的进程。
答案:A
16.(2011天津,14分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
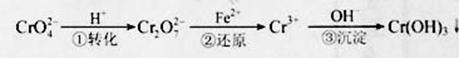
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72-和CrO42-的浓度相同
b.2v (Cr2O72-) =v (CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
解析:(1)pH=2说明溶液显酸性,平衡向正反应方向移动,Cr2O72-的浓度会增大,所以溶液显橙色;
(2)在一定条件下的可逆反应里,当正反应速率和逆反应速率相等,反应物的浓度与生成物的浓度不再改变时,该可逆反应就到达化学平衡状态,因此选项a不正确;在任何情况下Cr2O72-和CrO42-的反应速率之比总是满足1:2,因此选项b也不正确;溶液颜色不再改变,这说明Cr2O72-和CrO42-的浓度不再发生改变,因此可以说明反应已经达到化学平衡状态,c正确。
(3)Cr2O72-中Cr的化合价是+6价,所以1mol Cr2O72-被还原转移2×(6-3)=6mol电子;Fe2+被氧化生成Fe3+,转移1个电子,因此根据得失电子守恒可知需要FeSO4·7H2O的物质的量为6mol;
(4)由溶度积常数的表达式Ksp=c(Cr3+)·c3(OH-)=10-32可知,当c(Cr3+)=10-5mol/L时,c(OH-)=10-9mol/L,所以pH=5。
(5) Cr2O72-要生成Cr(OH)3沉淀,必需有还原剂,而铁做电极时,在阳极上可以失去电子产生Fe2+,方程式为Fe-2e-=Fe2+。
(6)在电解池中阳离子在阴极得到电子,在溶液中由于H+得电子得能力强于Fe2+的,因此阴极是H+放电,方程式为2H++2e-=H2↑,随着电解的进行,溶液中的H+浓度逐渐降低,水的电离被促进,OH-浓度逐渐升高。由于Fe2+被Cr2O72-氧化生成Fe3+,当溶液碱性达到一定程度时就会产生Fe(OH)3沉淀。
答案:(1)橙
(2)c
(3)6
(4)5
(5)阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
(6)2H++2e-=H2↑ Fe(OH)3
15.(2011上海19)常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
A.b不可能显碱性 B. a可能显酸性或碱性
C.a不可能显酸性 D.b可能显碱性或酸性
解析:pH都为11的氨水、氢氧化钠溶液,其浓度分别是大于10-3mol/L和等于10-3mol/L,由于pH为3的某酸溶液,其强弱未知。因此与pH为11的氨水反应时,都有可能过量;而与pH为11的氢氧化钠溶液反应时酸可能过量或二者恰好反应。
答案:AB
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com