
题目列表(包括答案和解析)
6.(2011山东高考11)下列与有机物结构、性质相关的叙述错误的是
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.苯 不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
解析:乙酸属于一元羧酸,酸性强于碳酸的,所以可与NaHCO3溶液反应生成CO2,A正确;油脂是高级脂肪酸的甘油酯,属于酯类,但不属于高分子化合物,选项B不正确;甲烷和氯气反应生成一氯甲烷,以及苯和硝酸反应生成硝基苯的反应都属于取代反应,C正确;只有分子中含有碳碳双键就可以与溴的四氯化碳溶液发生加成反应,从而使之褪色,D正确。
答案:B
5. (2011广东高考7)下列说法正确的是
A.纤维素和淀粉遇碘水均显蓝色
B.蛋白质、乙酸和葡萄糖均属电解质
C.溴乙烷与NaOH乙醇溶液共热生成乙烯[
D.乙酸乙酯和食用植物油均可水解生成乙醇
解析:本题考察常见有机物的结构和性质。只有淀粉遇碘水才显蓝色,A错误;在水溶液里或熔融状态下能够导电的化合物叫做电解质。蛋白质属于高分子化合物,是混合物,不是电解质,而葡萄糖属于非电解质,只有乙酸才属于电解质,B不正确;溴乙烷属于卤代烃,在NaOH乙醇溶液中共热发生消去反应,生成乙烯,C正确;食用植物油属于油脂,油脂是高级脂肪酸与甘油形成的酯,水解生成的醇是丙三醇即甘油,D不正确。
答案:C
4.(2011福建高考8)下列关于有机化合物的认识不正确的是
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的-CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
解析:在水溶液里,只有乙酸分子中的-COOH才可以电离出H+,电离方程式是
CH3COOH H++CH3COO-。这题是必修2有机内容,考查角度简单明了,不为难学生。
H++CH3COO-。这题是必修2有机内容,考查角度简单明了,不为难学生。
答案:C
3.(2011北京高考7)下列说法不正确的是
A.麦芽糖及其水解产物均能发生银镜反应
B.用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.用甘氨酸(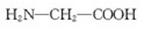 )和丙氨酸(
)和丙氨酸(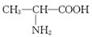 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
解析:麦芽糖属于还原性糖可发生银镜反应,麦芽糖的水解产物是葡萄糖,葡萄糖也属于还原性糖可发生银镜反应,A正确;苯酚和溴水反应生成白色沉淀,2,4-已二烯可以使溴水褪色,甲苯和溴水不反应,但甲苯可以萃取溴水中的溴,甲苯的密度比水的小,所以下层是水层,上层是橙红色的有机层,因此可以鉴别,B正确;酯类水解时,酯基中的碳氧单键断键,水中的羟基与碳氧双键结合形成羧基,所以CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH,因此选项C不正确;两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基与另一分子的羧基间脱去一分子水,缩合形成含有肽键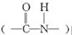 的化合物,成为成肽反应。因此甘氨酸和丙氨酸混合缩合是既可以是自身缩合(共有2种),也可是甘氨酸提供氨基,丙氨酸提供羧基,或者甘氨酸提供羧基,丙氨酸提供氨基,所以一共有4种二肽,即选项D正确。
的化合物,成为成肽反应。因此甘氨酸和丙氨酸混合缩合是既可以是自身缩合(共有2种),也可是甘氨酸提供氨基,丙氨酸提供羧基,或者甘氨酸提供羧基,丙氨酸提供氨基,所以一共有4种二肽,即选项D正确。
答案:C
2.(2011浙江高考11)褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。
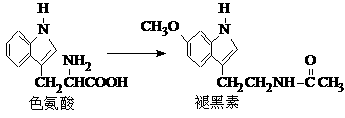
下列说法不正确的是
A.色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点
B.在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出
C.在一定条件下,色氨酸可发生缩聚反应
D.褪黑素与色氨酸结构相似,也具有两性化合物的特性
解析:A.正确。氨基酸形成内盐的熔点较高。
B.正确。氨基酸在等电点时,形成内盐,溶解度最小,易析出晶体。
C.正确。
D.错误。褪黑素的官能团为酰胺键,结构不相似。
答案:D
[评析]本题是一道有机题,考查了氨基酸的性质,特别是等电点的应用,同时能在辨认、区别色氨酸和褪黑素的官能团。
1.(2011江苏高考11)β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。
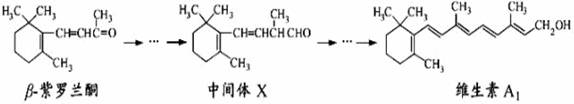
下列说法正确的是
A.β-紫罗兰酮可使酸性KMnO4溶液褪色
B.1mol中间体X最多能与2molH2发生加成反应
C.维生素A1易溶于NaOH溶液
D.β-紫罗兰酮与中间体X互为同分异构体
解析:该题以“β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1”为载体,考查学生对有机化合物的分子结构、官能团的性质、同分异构体等基础有机化学知识的理解和掌握程度。
A.β-紫罗兰酮中含有还原性基团碳碳双键,可使酸性KMnO4溶液褪色。
B.1mol中间体X含2mol碳碳双键和1mol醛基,最多能与3molH2发生加成反应
C.维生素A1以烃基为主体,水溶性羟基所占的比例比较小,所以难于溶解于水或水溶性的溶液如NaOH溶液。
D.β-紫罗兰酮比中间体X少一个碳原子,两者不可能互为同分异构体。
答案:A
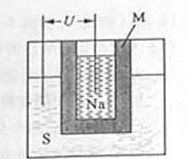
12.(2011山东高考29,14分)科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)下图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+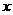 S=Na2
S=Na2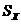 ,正极的电极反应式为
。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
,正极的电极反应式为
。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液PH
(填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
解析:(1)乙醇中还有羟基可以与金属钠反应放出氢气,化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;单质硫不溶于水,微溶于酒精,易溶液CS2,在加热时可与热的氢氧化钠溶液反应,因此要清洗附着在试管壁上的硫,可选用CS2或热的氢氧化钠溶液;
(2)由电池反应可与看出金属钠失去电子作为负极,单质硫得电子被还原成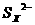 ,所以正极的电极反应式为XS+2e-=
,所以正极的电极反应式为XS+2e-=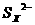 ;由于原电池内部要靠离子得定向运动而导电,同时钠和硫极易化合,所以也必需把二者隔离开,因此其作用是离子导电(导电或电解质)和隔离钠与硫;在铅蓄电池中铅作负极,反应式为Pb(s)+SO42-(aq)-2e-=PbSO4(s),因此当消耗1mol即207g铅时转移2mol电子,而207g钠可与失去的电子数为
;由于原电池内部要靠离子得定向运动而导电,同时钠和硫极易化合,所以也必需把二者隔离开,因此其作用是离子导电(导电或电解质)和隔离钠与硫;在铅蓄电池中铅作负极,反应式为Pb(s)+SO42-(aq)-2e-=PbSO4(s),因此当消耗1mol即207g铅时转移2mol电子,而207g钠可与失去的电子数为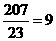 ,所以钠硫电池的理论放电量是铅蓄电池的9/2=4.5倍。
,所以钠硫电池的理论放电量是铅蓄电池的9/2=4.5倍。
(3)Na2S属于强碱弱酸盐S2-水解显碱性,所以c(H+)最小。但由于水解程度很小,大部分S2-还在溶液中。因为氢硫酸属于二元弱酸,所以S2-水解时分两步进行且以第一步水解为主,方程式为S2-+H2O=HS-+OH-、HS-+H2O=H2S+OH-,因此Na2S溶液中离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);由于S2-极易与Cu2+结合形成CuS沉淀而抑制S2-水解,因此溶液但碱性会降低,酸性会增强,方程式为S2-+Cu2+=CuS↓。S2-处于最低化合价-2价,极易失去电子而被氧化,空气中含有氧气可氧化S2-而生成单质硫,方程式为2S2-+O2+2H2O=2S↓+4OH-。
答案:(1)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CS2或热的氢氧化钠溶液;
(2)XS+2e-=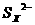 ;离子导电(导电或电解质)和隔离钠与硫;4.5;
;离子导电(导电或电解质)和隔离钠与硫;4.5;
(3)(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;2S2-+O2+2H2O=2S↓+4OH-。
11.(2011山东高考28,14分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为
。利用反应6NO2+ 8NH3 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6
kJ·mol-1
2SO3(g) ΔH=-196.6
kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡
状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
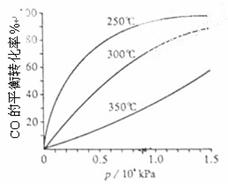
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“
<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“
<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
解析:(1)NO2溶于水生成NO和硝酸,反应的方程式是3NO2+H2O=NO+2HNO3;在反应6NO
+ 8NH3 7N5+12 H2O中NO2作氧化剂,化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为
7N5+12 H2O中NO2作氧化剂,化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为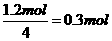 ,所以标准状况下的体积是
,所以标准状况下的体积是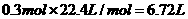 。
。
(2)本题考察盖斯定律的应用、化学平衡状态的判断以及平衡常数的计算。① 2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1
② 2NO(g)+O2(g)
2SO3(g) ΔH1=-196.6 kJ·mol-1
② 2NO(g)+O2(g) 2NO2(g) ΔH2=-113.0 kJ·mol-1 。②-①即得出2NO2(g)+2SO2(g)
2NO2(g) ΔH2=-113.0 kJ·mol-1 。②-①即得出2NO2(g)+2SO2(g) 2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1=-113.0 kJ·mol-1 +196.6 kJ·mol-1=+83.6 kJ·mol-1。所以本题的正确答案是41.8;反应NO2(g)+SO2(g)
2SO3(g)+2NO(g) ΔH=ΔH2-ΔH1=-113.0 kJ·mol-1 +196.6 kJ·mol-1=+83.6 kJ·mol-1。所以本题的正确答案是41.8;反应NO2(g)+SO2(g) SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。
SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。

(3)由图像可知在相同的压强下,温度越高CO平衡转化率越低,这说明升高温度平衡向逆反应方向移动,因此正反应是放热反应;实际生产条件的选择既要考虑反应的特点、反应的速率和转化率,还要考虑生产设备和生产成本。由图像可知在1.3×104kPa左右时,CO的转化率已经很高,如果继续增加压强CO的转化率增加不大,但对生产设备和生产成本的要求却增加,所以选择该生产条件。
答案:(1)3NO2+H2O=NO+2HNO3;6.72
(2)-41.8;b;8/3;
(3)< 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。
10.(2011福建高考23,15分)
I、磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
|
|
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
|
|
实验2 |
5 |
5 |
40 |
25 |
|
|
实验3 |
5 |
5 |
V2 |
0 |
|
该实验的目的是_____________________;表中V2=___________mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O === □Ce(OH)4↓+□_______
解析:(1)P属于第15号元素,其原子的结构示意图为: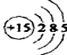 ;
;
(2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4=20或C化合价由0价变成为+2价,电子转移为2×10=20;
(3)n(Na2S2O3)=bV1/1000 mol;与其反应的I2为bV1/2000 mol,与维生素C反应的I2为 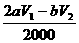 mol,即维生素C的物质的量是
mol,即维生素C的物质的量是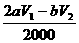 mol(或其它合理答案);
mol(或其它合理答案);
(4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系。
(5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可以完整答出:NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。
(6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式。2Ce3++H2O2+6H2O=== 2Ce(OH)4↓+6H+
此题考查原子结构示意图,氧化还原反应的配平与电子转移计算,滴定中的简单计算,水解知识,实验探究变量的控制等,上述皆高中化学中的主干知识。题设中的情景都是陌生的,其中还涉及到稀土知识,其中第(4)小问是该题亮点,设问巧妙,有点类似于2010全国新课标一题,但题目设计更清晰,不拖泥带水。第6小问的缺项配平有点超过要求,但题中给出提示,降低了难度。
这题拼凑痕迹比较明显,每小问前后联系不强,或者说没有联系。
答案:(1) ;
;
(2)20;
(3)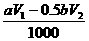 ;
;
(4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(或其他合理答案);
(5)分解出HCl气体,抑制CeCl3的水解(或其他合理答案);
(6)2Ce3++H2O2+6H2O=== 2Ce(OH)4↓+6H+。
9.(2011浙高考26,15分)食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:
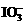 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: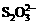 >I-;
>I-;
3I2+6OH-
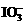 +5I-+3H2O;
+5I-+3H2O;
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_________(用化学式表示);CCl4中显紫红色的物质是___________________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为___________________________、______________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:__________________________________________________________________________。
解析:(1)①Fe3+与SCN-的配合产物有多种,如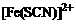 、
、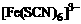 等;I2的CCl4溶液显紫红色。②应用信息:“氧化性:
等;I2的CCl4溶液显紫红色。②应用信息:“氧化性: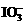 >Fe3+>I2”,说明
>Fe3+>I2”,说明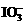 和Fe3+均能氧化I-生成I2。
和Fe3+均能氧化I-生成I2。
(2)KI被潮湿空气氧化,不能写成I-+O2+H+→,要联系金属吸氧腐蚀,产物I2+KOH似乎不合理(会反应),应考虑缓慢反应,微量产物I2会升华和KOH与空气中CO2反应。
KI3·H2O作加碘剂问题,比较难分析,因为KI3很陌生。从题中:“低温条件下可制得”或生活中并无这一使用实例来去确定。再根据信息:“KI+I2 KI3”解析其不稳定性。
KI3”解析其不稳定性。
(3)根据信息“还原性: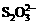 >I-”可判断A;C比较难分析,应考虑食盐潮解主要是Mg2+、Fe3+引起,加Na2CO3能使之转化为难溶物;D中NaNO2能氧化I―。
>I-”可判断A;C比较难分析,应考虑食盐潮解主要是Mg2+、Fe3+引起,加Na2CO3能使之转化为难溶物;D中NaNO2能氧化I―。
(4)实验方案简答要注意规范性,“如取…加入…现象…结论…”,本实验I―对Fe2+的检验有干扰,用过量氯水又可能氧化SCN-,当然实际操作能判断,不过对程度好的同学来说,用普鲁士蓝沉淀法确定性强。
答案:(1)①Fe(SCN)3 
②IO3-+5I-+6H+=3I2+3H2O 2Fe3++2I-=2Fe2++I2
(2)O2+4I-+2H2O=2I2+4KOH
否 KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华。
(3)AC
(4)取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶于,若显血红色,则该加碘盐中存在Fe2+。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com