
题目列表(包括答案和解析)
11.铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
答案:C
解释:根据电池的总反应,由元素的化合价的升降判断,Fe失去电子,发生了氧化反应生成Fe(OH)2故为负极,Ni2O3得到电子,发生了还原反应生成Ni(OH)2为正极。电池充电时电极反应与放电时的反应相反,阴极上Fe(OH)2发生了还原反应产生OH-,阴极附近溶液的pH升高,故C错。
10.将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A. c(H+)
B. Ka(HF)
C.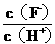 D.
D. 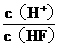
答案:D
解释:加水不断稀释过程中,HF的电离程度不断增大,H+的数目不断增多,HF分子数目不断减少,c(H+)/c(HF) 始终保持增大。
9.下列反应中,属于取代反应的是
①CH3CH=CH2+Br2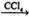 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH 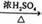 CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH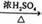 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3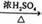 C6H5NO2+H2O
C6H5NO2+H2O
A. ①② B.③④ C.①③ D.②④
答案:B
解释:①是加成反应,②是消去反应,③是酯化反应,④是硝化反应。酯化反应和硝化反应为取代反应。B正确。
8.分子式为C5H11Cl的同分异构体共有(不考虑立体异构)
A.6种 B.7种 C. 8种 D.9种
答案:C
解释:考虑碳链异构和氯原子的位置异构。主链5碳的有3种,主链4碳的有4种,主链3碳的有1种。共8种。
7.下列叙述正确的是
A.1.00mol NaCl中含有6.02×1023个NaCl分子
B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
答案:B
解释:A项中无NaCl分子,C项中不是溶于1.00L水,而应是配成1.00L溶液,D项中产生的氯气只有0.5mol即11.2L(标准状况)。B正确。
28.((13分)地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题。文献报道某课题组模拟地下 水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0. 1mol
1mol
 L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入 (写化学式)。
L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入 (写化学式)。
(2)右图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式 。t1时刻后,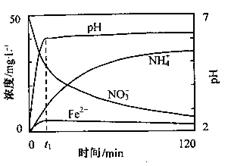 该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是
该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是  。
。

26.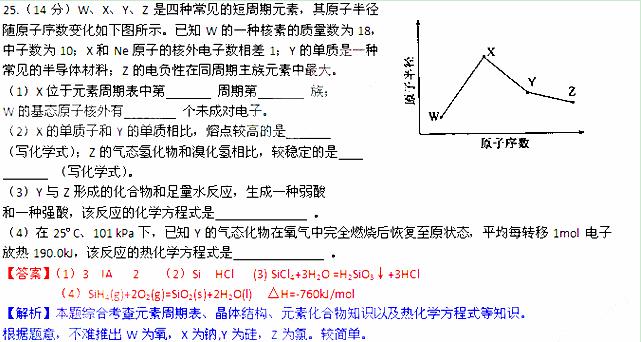 (17分)室安卡因(G)是一种抗心率天常药物,可由下列路线合成;
(17分)室安卡因(G)是一种抗心率天常药物,可由下列路线合成;


(1)已知A是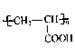 的单体,则A中含有的官能团是 (写名称)。B的结构简式是 。
的单体,则A中含有的官能团是 (写名称)。B的结构简式是 。
(2)C的名称(系统命名)是 ,C与足量NaOH醇溶液共热时反应的化学方程式是
。
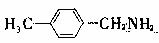
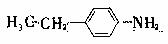
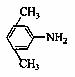
(3)X是E的同分异构题,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有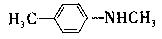 、 、 、 。
、 、 、 。
(4)F→G的反应类型是 。
(5)下列关于室安卡因(G)的说法正确的是 。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d..属于氨基酸
[答案](1)碳碳双键 羧基
(2)2-溴丙酸 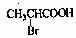 +2NaOH
+2NaOH →
→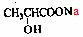 +NaBr+
H2O
+NaBr+
H2O
(3) 
(4)取代
(5)abc
[解析]本题综合考查有机化学的命名,同分异构,官能团及性质等相关知识。较为简单,只要稍有能力的学生都能做好。
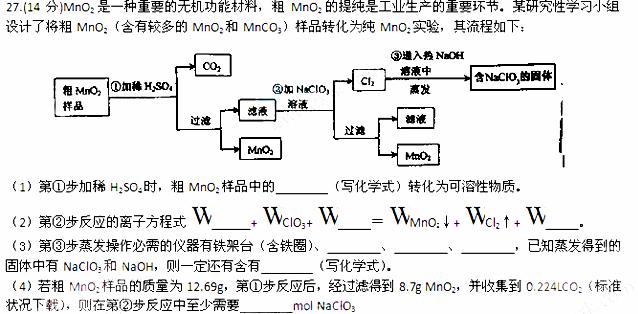 [答案](1)MnO2和MnCO3
[答案](1)MnO2和MnCO3
(2)5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
(3)蒸发皿 酒精灯 玻璃棒 NaCl
(4)0.02
[解析]本题综合考查离子反应方程式书写、氧化还原反应配平、化学计算以及化学实验的 相关知识。情景较为简单,工艺流程清晰。
相关知识。情景较为简单,工艺流程清晰。
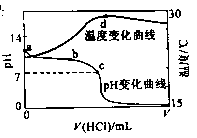
13.室温下,将1.000mol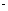
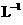 盐酸滴入20.00mL 1.000mol
盐酸滴入20.00mL 1.000mol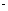
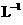 氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关
氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关 说法正确的是
说法正确的是
A. a点由水电离出的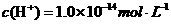
B. b点: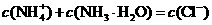
C.c点: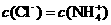
D.d点后,容易温度略下降的主要原因是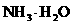 电离吸热
电离吸热
[答案]C
[解析]本题综合考查水溶液中的电离平衡以及酸碱中和滴定的相关知识。
a点7<pH<14,因此水电离出的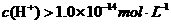 ,A错;b点时盐酸和氨水反应,氨水过量,此等式不成立,B错;c点溶液呈中性,根据电荷守恒此等式成立,C正确。d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因。
,A错;b点时盐酸和氨水反应,氨水过量,此等式不成立,B错;c点溶液呈中性,根据电荷守恒此等式成立,C正确。d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因。
12.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差 别进行发电,在海水中电池总反应可表示为:
别进行发电,在海水中电池总反应可表示为: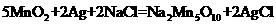 下列“水”
电池在海水中放电时的有关说法正确的是:
下列“水”
电池在海水中放电时的有关说法正确的是:
A.正极反应式: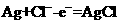
B.每生成1 m ol
ol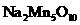 转移2 mol电子
转移2 mol电子
C. 不断向“水”电池的负极移动
不断向“水”电池的负极移动
D.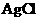 是还原产物
是还原产物
[答案]D
[解析]本题综合考查原电池和氧化还原反应的相关知识。
 正极反应该得电子,因此A错;原电池中电解质溶液中的阳离子应该向正极移动,C错;Ag是反应的还原剂,因此
正极反应该得电子,因此A错;原电池中电解质溶液中的阳离子应该向正极移动,C错;Ag是反应的还原剂,因此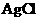 是氧化产物,D错。
是氧化产物,D错。
11. 中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元 素最高正价都是+7
素最高正价都是+7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出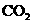 通入NaClO溶液中能生成HClO
通入NaClO溶液中能生成HClO
[答案]D
[解析]本题综合考查化学反应原理中的共性与特性。
A应考虑到IIA族第一电离能反常;B应考虑到F无正价;C应考虑到常温下pH<7溶液才为酸性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com