
题目列表(包括答案和解析)
5.已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
4. 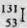 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中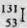 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关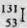 的叙述中错误的是
的叙述中错误的是
A. 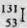 的化学性质与
的化学性质与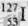 相同 B.
相同 B. 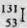 的原子序数为53
的原子序数为53
C. 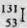 的原子核外电子数为78 D.
的原子核外电子数为78 D. 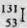 的原子核内中子数多于质子数
的原子核内中子数多于质子数
3. 下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. HClO3和K2SO4 D. Na2SO3和BaCO3
2.用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为

A. 22.30mL B. 22.35mL C. 23.65mL D. 23.70mL
1.下列化合物中,在常温常压下以液态形式存在的是
A. 甲醇 B. 乙炔 C. 丙烯 D. 丁烷
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)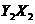 分子中Y原子轨道的杂化类型为
▲
,1mol
分子中Y原子轨道的杂化类型为
▲
,1mol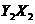 含有
含有 键的数目为 ▲ 。
键的数目为 ▲ 。
(2)化合物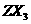 的沸点比化合物
的沸点比化合物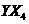 的高,其主要原因是
▲
。
的高,其主要原因是
▲
。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 ▲ 。
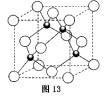
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是 ▲
,它可与浓盐酸发生非氧化还原反应,生成配合物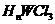 ,反应的化学方程式为 ▲
。
,反应的化学方程式为 ▲
。
B.草酸是一种重要的化工产品。实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
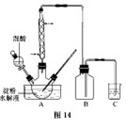
实验过程如下:
① 将一定量的淀粉水解液加入三颈瓶中
② 控制反应液温度在55-60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液
③ 反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3 →3H2C2O4+9NO2↑ +3NO↑ +9H2O
C6H12O6+8HNO3 →6CO2+8NO↑ +10H2O
3H2C2O4+2HNO3 →6CO2+2NO↑ +4H2O
(1) 检验淀粉是否水解完全所需用的试剂为 ▲
(2) 实验中若混酸滴加过快,将导致草酸产率下降,其原因是 ▲
(3) 装置C用于尾气吸收,当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NO,全部吸收,原因是 ▲ (用化学方程式表示)
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是 ▲ 。
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 ▲ 。
20.(14分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: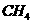 (g)+
(g)+ 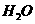 (g)====
(g)==== (g)+
(g)+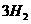 (g)
(g)  =
= 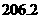
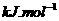
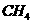 (g)+
(g)+ 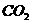 (g)====
(g)==== (g)+
(g)+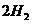 (g)
(g) =
= 
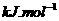
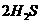 (g)====
(g)====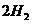 (g)+
(g)+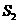 (g)
(g)  =
= 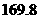
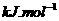
(1) 以甲烷为原料制取氢气是工业上常用的制氢方法。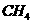 (g)与
(g)与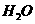 (g)反应生成
(g)反应生成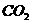 (g)和
(g)和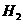 (g)的热化学方程式为______。
(g)的热化学方程式为______。
(2) 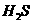 热分解制氢时,常向反应器中通入一定比例空气,使部分
热分解制氢时,常向反应器中通入一定比例空气,使部分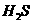 燃烧,其目的是_____;燃烧生成的
燃烧,其目的是_____;燃烧生成的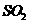 与
与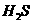 进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_______。
进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_______。
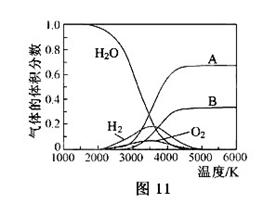
(3)H O的热分解也可得到H
O的热分解也可得到H ,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是_______。
,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是_______。
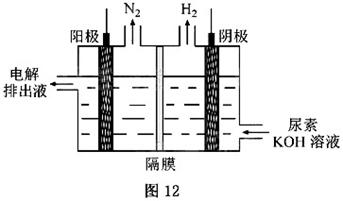
(4)电解尿素[CO(NH )
) ]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_______。
]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_______。
(5)Mg Cu是一种储氢合金。350℃时,Mg
Cu是一种储氢合金。350℃时,Mg Cu与H
Cu与H 反应,生成MgCu
反应,生成MgCu 和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg
和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg Cu与H
Cu与H 反应的化学方程式为_______。
反应的化学方程式为_______。
19.(15分)高氯酸按(NH ClO
ClO )是复合火箭推进剂的重要成分,实验室可通过下列反应制取
)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NaCl0 (aq)+NH
(aq)+NH Cl(aq)
Cl(aq) NH
NH ClO
ClO (aq)+NaCl(aq)
(aq)+NaCl(aq)
(1)若NH Cl用氨气和浓盐酸代替,上述反应不需要外界供
Cl用氨气和浓盐酸代替,上述反应不需要外界供
热就能进行,其原因是 。
。
(2)反应得到的混合溶液中NH ClO
ClO 和NaCI的质量分数分
和NaCI的质量分数分
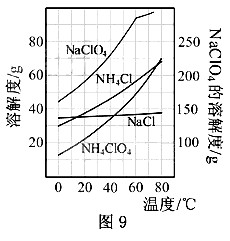
别为0.30和0.l5(相关物质的溶解度曲线见图9)。从
混合溶液中获得较多NH CIO
CIO 晶体的实验操作依次为
晶体的实验操作依次为
(填操作名称) 干燥。
干燥。
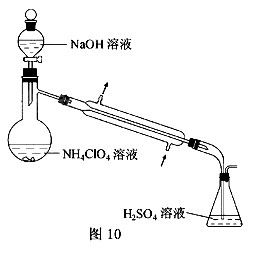 (3)样品中NH
(3)样品中NH CIO
CIO 的含量可用蒸馏法进行测定,蒸馏装置
的含量可用蒸馏法进行测定,蒸馏装置
如图10所示(加热和仪器固定装代已略去),实验步骤
如下:
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约0.1mol•L-¹ H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL 3mol•L-¹NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中神域约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol•L-¹ NaOH标准溶液滴定至终点,消耗NaOH标准溶液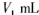
步骤8.将实验步骤1-7重复2次
① 步骤3中,准确量取40.00ml H2SO4 溶液的玻璃仪器是________.
② 步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③ 为获得样品中NH4ClO4 的含量,还需补充的实验是 _____
18.(12分) 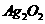 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在 加入适量
加入适量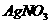 溶液,生成
溶液,生成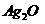 沉淀,保持反应温度为80,边搅拌边将一定量
沉淀,保持反应温度为80,边搅拌边将一定量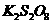 溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
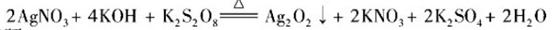
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是 ▲ .
(2)银锌碱性电池的电解质溶液为 溶液,电池放电时正极的
溶液,电池放电时正极的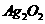 转化为
转化为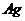 ,负极的
,负极的 转化为
转化为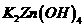 ,写出该电池反应方程式:
▲
.
,写出该电池反应方程式:
▲
.
 (3)准确称取上述制备的样品(设
(3)准确称取上述制备的样品(设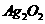 仅含和
仅含和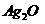 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为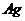 和
和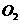 ,得到224.0mL
,得到224.0mL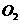 (标准状况下)。计算样品中
(标准状况下)。计算样品中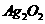 的质量分数(计算结果精确到小数点后两位)。
的质量分数(计算结果精确到小数点后两位)。
17. (15分)敌草胺是一种除草剂。它的合成路线如下:
回答下列问题:
(1)在空气中久置,A由无色转变为棕色,其原因是 ▲ 。
(2)C分子中有2个含氧官能团,分别为 ▲ 和 ▲ 填官能团名称)。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:▲ 。
①能与金属钠反应放出H2;②是萘( )的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧。
)的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧。
(4)若C不经提纯,产物敌草胺中将混有少量副产物E(分子式为C23H18O3),E是一种酯。E的结构简式为 ▲ 。
(5)已知: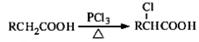 ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备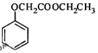 的合成路线流程图(无机试剂任用)。合成路线流程图例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图例如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com