
题目列表(包括答案和解析)
17.(9分)硫酸亚铁铵[(NH2)2SO4·FeSO·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol·L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1) 在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研体 ⑥ 玻璃棒 ⑦ 酒精灯
(2) 在步骤2中所加的硫酸必须过量,其原因是_______;
(3) 在步骤3中,“一系列操作”依次为______、_______和过滤;
(4) 本实验制的的硫酸亚铁铵晶体常含有Fe杂质。检验Fe3常用的试剂是______,可以观察到得现象是________。
选考题(请考生在请18.19.20三题中任选一题作答,如果多做,则按所做的第一题计分。作答时用2B铅笔在答题卡上把所选题目的题号涂黑。)
第18.19.20三题的第一题为选择题,在给出的四个选项中,至少有两项是符合题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第二题为非选择题,请在答题卡上相应位置作答并写明小题号。
16.(8分)乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
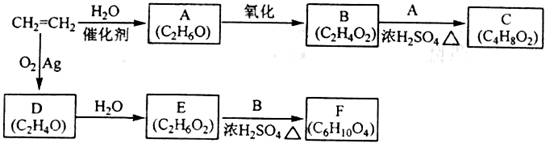
请回答下列问题:
(1) A的化学名称是_______;
(2) B和A反应生成C的化学方程式为___________,该反应的类型为_____________;
(3) D的结构简式为___________;
(4) F的结构简式为_____________;
(5) D的同分异构体的结构简式为___________。
15.(9分)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的CL2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为__________;
(2)估算该反应的平衡常数__________(列式计算)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。
14.(9分)镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填化学式);
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是_____________,该化合物水解的化学方程式为_________________;
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
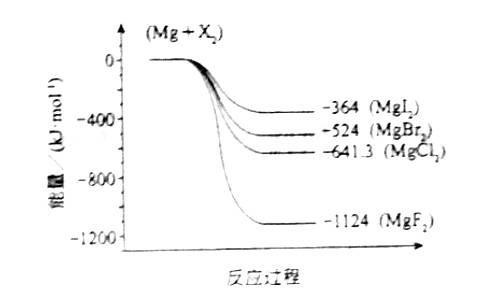
下列选项中正确的是_______________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
11.某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是
A.正反应活化能小于100kJ·mol-1
B.逆反应活化能一定小于100kJ·mol-1
C.正反应活化能不小于100kJ·mol-1
D.正反应活化能比逆反应活化能大100kJ·mol-1
12根据右图,下列判断中正确的是

A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-=H2
D.烧杯b中发生的反应为2Cl--2e-=Cl2
第II卷
本卷包括必考题和选考题两部分,第13题~第17题为必考题,每个试卷考生都必须做答。第18题~第20题为选考题,考生根据要求做答。
13(9分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。

请回答下列问题:
(1)元素Z位于周期表中第______________周期,___________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
10.设NA是阿伏伽德罗常数的数值,下列说法正确的是
A.1molAl3+离子含有的核外电子数为3NA
B.1molCl2与足量的铁反应,转移的电子数为3NA
C.10LpH=1的硫酸溶液中含有的H+离子数为2NA
D.10LpH=13的NaOH溶液中含有的OH-离子数为NA
9.“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
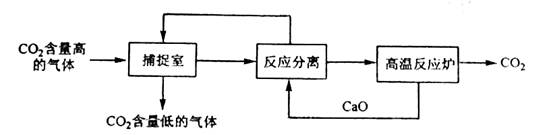
下列有关该方法的叙述中正确的是
A.能耗大是该方法的一大缺点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶。过滤
D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
8. 对于可逆反应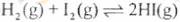 ,在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是
,在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是
A. H2(g)的消耗速率与HI(g)的生成速率比为2:1
B. 反应进行的净速率是正、逆反应速率之差
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,正、逆反应速率相等
7. 下列化合物的分子中,所有原子都处于同一平面的有
A. 乙烷 B. 甲苯 C. 氟苯 D. 四氯乙烯
6.一种充电电池放电时的电极反应为
H2+2OH-2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH-
当为电池充电时,与外电源正极连接的电极上发生的反应是
A. H2O的还原 B. NiO(OH)的还原
C. H2的氧化 D. NiO(OH) 2的氧化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com