
题目列表(包括答案和解析)
7.下列叙述中正确的是 ( )
A.干冰气化时化学键发生断裂
B.SiO2晶体有多种晶型,其基本结构单元是[SiO4]四面体结构
C.Na2O和Na2O2所含化学键类型完全相同
D.Br2蒸气被木炭吸附时共价键被破坏
6.下列各分子中所有原子都满足最外层为8电子结构的是 ( )
A.BeCl2 B.HClO C.PCl5 D.N2
5.下列关于元素的叙述正确的是 ( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
4.下列各组物质中,化学键类型完全相同的是 ( )
A.HI和NaI B.H2S和CO2
C.Cl2和CCl4 D.F2和NaBr
3.X、Y均为短周期元素,且X为第ⅠA族元素,Y为第ⅥA族元素,下列说法正确的是 ( )
A.X的原子半径一定大于Y的原子半径
B.由X、Y形成的共价化合物中所有原子都满足最外层为8电子结构
C.X2Y既可能是离子化合物,也可能是共价化合物
D.由X、Y组成的化合物中,X、Y的原子个数比不可能是1∶1
2.下列说法中,正确的是 ( )
A.离子化合物中一定不含共价键
B.共价化合物中一定不含离子键
C.完全由非金属元素形成的化合物中不含离子键
D.当水变成水蒸气时共价键断裂
1.下列含有共价键的离子化合物的是 ( )
A.Na2O B.CaCl2 C.NH4Cl D.H2O2
20.[选修2--化学与技术](20分)
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为

B.海水提镁的主要步骤为
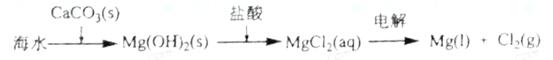
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
20-II(14分)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为___________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
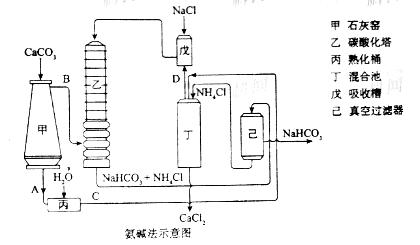
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为_______;
(3)联合制碱法对氨碱法的改进,其优点是______________;
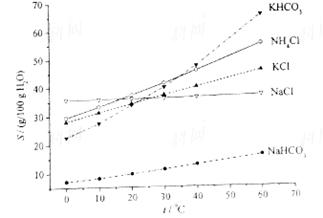
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。
19.[选修3--物质结构与性质](20分)
19-I(6分)下列分子中,属于非极性的是
A.SO2 B.BeCl2 C.BBr3 D.COCl2
19-II(14分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)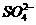 的立体构型是________,其中S原子的杂化轨道类型是_______;
的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
18.[选修5--有机化学基础](20分)
18-1(6分)下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:2的是
18-11(14)PCT是一种新型聚酯材料,下图是某研究小组合成PCT的路线。
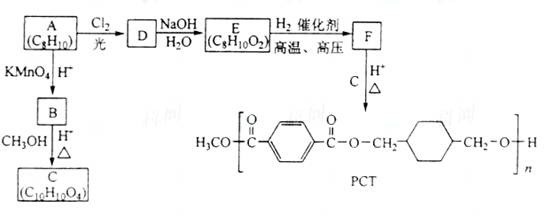
请回答下列问题:
(1) 由A生成D的化学方程式为________;
(2) 由B生成C的反应类型是________________,C的化学名称为______________;
(3) 由E生成F的化学方程式为____________,该反应的类型为__________________;
(4) D的同分异构体中为单取代芳香化合物的有____________(写结构简式)
(5) B的同分异构体中,能发生水解反应,且苯环上一氯代产物只有一种的是________(写结构简式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com