
题目列表(包括答案和解析)
11.B 12.A
16.(10分)(2009·四川理综,27)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴、阳离子的个数比为2∶3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。

请回答下列问题:
(1)组成B单质的元素位于周期表第________周期,第________族。化合物C的电子式为________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是____________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:______________________。
(4)写出D与足量的N反应生成E和F的化学方程式:________________________。
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有_____个。
答案 1.C 2.B 3.C 4.B 5.A 6.D 7.B 8.C 9.C 10.C
15.(12分)已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)X、Z两种元素的元素符号:X____________________、Z______________________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),由X、Z、W三元素形成的离子化合物的电子式为________,两种化合物的浓溶液混合共热的离子反应方程式为___________________________________________________________________。
(4)X与W形成的化合物的电子式为________,将该化合物溶于水,发生反应的化学方程式为______________________,其中水做________剂(填“氧化”或“还原”)。
14.(10分)共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量。如H-H键的键能是436 kJ/mol,是指使1 mol H2分子变成2 mol H原子需吸收436 kJ的能量。
(1)已知H-Cl键的键能为431.4 kJ/mol,下列关于键能的叙述正确的是______。
A.每生成1 mol H-Cl键放出431.4 kJ能量
B.每生成1 mol H-Cl键吸收431.4 kJ能量
C.每拆开1 mol H-Cl键放出431.4 kJ能量
D.每拆开1 mol H-Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是________。
|
化学键 |
H-H |
H-F |
H-Cl |
H-Br |
|
键能/kJ/mol |
436 |
565 |
431 |
368 |
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是________。
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243 kJ/mol,试求1 mol H2在足量的Cl2中燃烧,理论上放出的热量是________(其他形式的能量很少,可忽略不计)。
13.(8分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是________,该化合物是由________键形成的。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是____________。
(3)Na3N与水的反应属于______(填基本反应类型)反应。
(4)比较Na3N中两种微粒的半径:r(Na+)______r(N3-)(填“>”、“=”或“<”)。
12.A、B是短周期第ⅦA族元素,元素A的非金属性比B强,下列有关A、B的说法中正确的是 ( )
A.NaA、NaB都是离子化合物
B.单质A可把B从NaB的溶液中置换出来
C.HA比HB稳定性强的原因是1 mol HA分子中H-A键断裂时需要吸收的能量比
1 mol HB分子中H-B键断裂时需要吸收的能量少
D.常温下,NaA、NaB溶液的pH均大于7
11.下列电子式的书写中,正确的是 ( )
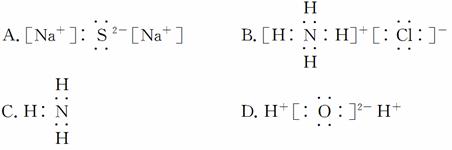

10.下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.水溶液能导电
B.由金属和非金属元素的原子组成
C.熔融状态能导电
D.可以溶于水
9.下列每组中各物质内既有离子键又有共价键的一组是 ( )
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
8.1999年曾报道合成和分离了含高能量正离子N的化合物N5AsF6,下列叙述错误的是 ( )
A.N共有34个核外电子
B.N中氮原子以共用电子对结合
C.化合物N5AsF6中As的化合价为+1
D.化合物N5AsF6中F的化合价为-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com