
题目列表(包括答案和解析)
9.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
[解析] 根据公式:pV=nRT⇒pV=RT⇒pM=ρRT可知当T、ρ相同时,p与M(摩尔质量)成反比。
[答案] D
8.在相同的温度和压强下,4个容器中分别装有4种气体。已知各容器中的气体和容器的容积分别是a.CO2,100 mL;b.O2,200 mL;c.N2,400 mL;d.CH4,600 mL,则4个容器中气体的质量由大到小的顺序是( )
A.a>b>c>d B.b>a>d>c
C.c>d>b>a D.d>c>a>b
[解析] 据阿伏加德罗定律:
n(CO2)∶n(O2)∶n(N2)∶n(CH4)
=V(CO2)∶V(O2)∶V(N2)∶V(CH4)
=100 mL∶200 mL∶400 mL∶600 mL=1∶2∶4∶6
m(CO2)∶m(O2)∶m(N2)∶m(CH4)
=(1×44)∶(2×32)∶(4×28)∶(6×16)
=11∶16∶28∶24
所以 c>d>b>a。
[答案] C
7.(2010年长春市调研)下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5 mol氨气 ②4 g氦气 ③4 ℃时9 mL水 ④0.2 mol磷酸钠
A.①④③② B.④③②①
C.②③④① D.①④②③
[解析] ①中原子物质的量0.5 mol×4=2 mol;②中原子1 mol;③中原子×3=1.5 mol;④中原子0.2 mol×8=1.6 mol,故原子数由大到小为①④③②。
[答案] A
6.设NA为阿伏加德罗常数的值,下列说法不正确的是(多选)( )
A.1 mol O2与金属钠反应,O2一定得到4NA个电子
B.标准状况下,a L CH4和a L C6H14中所含分子数均为aNA/22.4
C.常温常压下,1 mol Cl2与足量的金属镁反应,转移2NA个电子
D.在20 ℃、1.01×105 Pa时,2.8 g C2H4和CO的混合气体所含气体分子数等于0.1NA
[解析] A选项,当O2与钠反应生成Na2O2时,1 mol O2只能得到2NA个电子;B选项,标准状况下C6H14为液态;D选项,2.8 g C2H4和CO的混合气体的物质的量一定为0.1 mol,因此所含气体分子数等于0.1NA。
[答案] AB
5.(2009年上海高考)NA代表阿伏加德罗常数。下列有关叙述正确的是( )
A.标准状况下,2.24 L H2O含有的分子数等于0.1NA
B.常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数大于0.1NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N-H键数目为0.2NA
[解析] A项,标准状况下水是液态。B项,Na2CO3溶液中存在反应:CO32-+H2OHCO3-+OH-,故100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数大于0.1NA。C项,没有注明是否是标准状况,体积不一定是22.4 L。D项,一个NH3分子中含3个N-H键,则3.4 g即0.2 mol NH3中含N-H键数目为0.6NA。
[答案] B
4.(2010年宁波十校联考)阿伏加德罗常数为6.02×1023 mol-1,下列说法正确的是( )
A.1 mol HClO完全分解时转移电子数为4×6.02×1023
B.a L O2和N2的混合物中含有的分子数为×6.02×1023
C.100 mL 0.1 mol/L的Al2(SO4)3溶液中含有的Al3+数为0.02×6.02×1023
D.常温下,42 g C2H4和C4H8的混合物中含有的碳原子数为3×6.02×1023
[解析] 2HClO===2HCl+O2↑-转移4 e-,1 mol HClO完全分解转移2×6.02×1023个电子,A项错误;混合气的温度、压强不知道,只由体积不能确定混合气中的分子数,B项错误;Al3+在水溶液中有部分水解,故含0.01 mol Al2(SO4)3溶液中Al3+数小于0.02×6.02×1023,C项错误。
[答案] D
3.物质的体积一定是22.4 L的是( )
A.1 mol水蒸气
B.17 g氨气
C.标准状况下44 g二氧化碳
D.0 ℃、202 kPa时2 g氢气
[解析] STP时1 mol气体的体积为22.4 L。水蒸气一定不是处于STP;氨气未明确所处的状态;0 ℃、202 kPa不是STP。
[答案] C
2.下列说法正确的是( )
A.NaOH的摩尔质量为40 g
B.1 mol O2的质量与它的相对分子质量相等
C.1 mol OH-的质量为17 g·mol-1
D.氦气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量
[解析] A错,摩尔质量的单位是g·mol-1。B错,1 mol O2的质量在数值上与它的相对分子质量相等。C错,质量的单位是g。D是对的,要注意氦气是单原子分子气体。
[答案] D
1.下列对“摩尔”的叙述不正确的是( )
A.摩尔是一个单位,可用于计量物质所含微观粒子的多少
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1 mol任何气体所含的气体分子数目都相等
D.用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计量思路都是扩大单位
[解析] 掌握“摩尔”概念的引入及“1 mol”的含义对于理解物质的量及有关计算特别重要。D项考查了定量研究的方法,用“摩尔”即 不用“个”的思路是“化小为大”(单个微粒不可称,可以取大量微粒,即微粒集体,即“化小为大”);用“纳米”而不用“米”(用米衡量原子直径,使用不方便,可采用“化大为小”,采用纳米单位)是采用“化大为小”的思路。
[答案] D
(三)模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
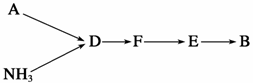
(4)A中反应的离子方程式为_______________________________________________。
(5)D装置中的液体可换成 (填序号)。
a.CuSO4 b.H2O c.CCl4 d.浓硫酸
(6)该同学所设计的模拟尾气处理实验还存在的明显缺陷是______________________。
14. (10分)下图中A-J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
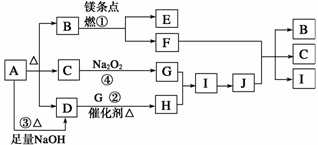
请填写以下空白:
(1)A的化学式 。
(2)写出反应①②的化学方程式:
①________________________________________________________________________,
②________________________________________________________________________。
(3)写出反应③的离子方程式:__________________________________________。
(4)J与F反应的化学方程式:______________________________________________。
(5)在反应④中,当生成标况下2.24 L G时,转移电子数为 mol。
15. (12分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
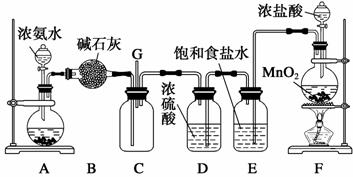
请回答下列问题:
(1)装置F中发生反应的离子方程式为________________________________________。
(2)装置A的烧瓶中可装试剂_______________________________________________。
(3)B装置的名称是________________________________________________________;
E装置的作用__________________________________________________________。
(4)通入C装置的两根导管左边较长、右边较短,目的是_________________________。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________________________________________________。
当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(用含a、b的代数式表示)_________________________________________________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?____________________________________________________________________________
16. (6分)在50 mL a mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO)=3 mol/L。
(1)求稀释后的溶液pH= 。
(2) 若a=9,则生成的气体中NO2的物质的量为 mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为 mL。
答案 1 .C 2 . D 3 .A 4 . A 5 .D 6 .C 7 .B 8 .D 9 .D 1 0 .A
11 .B 12 . B
13. (1)①③⑤ (2)C或G
(3)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O或CaO+NH3·H2O===NH3↑+Ca(OH)2(要对应)
(4)3Cu+2NO+8H+===3Cu2++2NO↑+4H2O
(5)c (6)NO尾气直接排放,没有进行处理
14. (1)NH4HCO3
(2)①2Mg+CO22MgO+C
②4NH3+5O2催化剂△4NO+6H2O
(3)NH+HCO+2OH-NH3↑+CO+2H2O
(4)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
(5)0.2
15. (1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)生石灰或固体氢氧化钠
(3)干燥管 除去氯气中的氯化氢
(4)使密度大的氯气与密度小的氨气较快地均匀混合
(5)3Cl2+8NH3===N2+6NH4Cl b/2a mol-1
(6)在G连接导管直接通入盛有烧碱的烧杯中
16 . (1)0 (2)0.125 (3)150
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com