
题目列表(包括答案和解析)
4.某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,300 mL该溶液中Cl-离子的物质的量约等于( )
A.0.37 mol B.0.63 mol
C.0.74 mol D.1.5 mol
[解析] 该溶液的质量为1.18 g·cm-3×300 mL=354 g
m(Mg2+)=354 g×5.1%
则n(Cl-)=2n(Mg2+)=2×=1.5 mol。
[答案] D
3.(2010年杭州质检)传统的引爆炸药由于其中含Pb,使用时将产生污染,同时其引爆后的剩余炸药还严重危害接触者的人身安全,美国UNC化学教授Thomas J.Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物。已知10 mL Na2R溶液含Na+的微粒数为N个,该Na2R溶液的物质的量浓度为( )
A.N×10-2 mol/L B. mol/L
C.mol/L D.mol/L
[解析] 10 mL Na2R溶液中含Na+的微粒数为N个,Na2R的物质的量=mol,Na2R的物质的量浓度=mol÷0.01 L=mol/L。
[答案] B
2.300 mL Al2(SO4)3溶液中,含Al3+ 1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度为(不考虑盐类水解)( )
A.0.4 mol·L-1 B.0.3 mol·L-1
C.0.2 mol·L-1 D.0.1 mol·L-1
[解析] 300 mL Al2(SO4)3溶液中n(SO42-)=× mol=0.09 mol,n(Ba2+)=0.03 mol,消耗SO42- 0.03 mol,则反应后溶液中c(SO42-)= mol·L-1=0.1 mol·L-1。
[答案] D
1.下列说法中正确的是( )
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g
[解析] A项中误把水的体积当溶液体积计算溶液的物质的量浓度;B项中取出溶液的浓度应与原溶液浓度相同;C项:m(CuSO4·5H2O)=0.5 L×0.5 mol·L-1×250 g·mol-1=62.5 g,该项正确;D项:m(NaOH)=2×0.1 L×1 mol·L-1×40 g·mol-1=8 g。
[答案] C
15.生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是____________。
(2)原混合气体中氮气的体积分数为________。
[解析] 设CH4为x mol,原混合气体中CO2为y mol,则有
CH4+4CuOCO2+2H2O+4Cu Δm
1 mol 1 4×16 g
x x 4.8 g
x=0.075 mol
又因为n总==0.09 mol,
n(CO2)==0.085 mol,
所以 y=0. 085 mol-0.075 mol=0.01 mol
n(N2)=0.09 mol-0.01 mol-0.075 mol=0.005 mol
所以N2的体积分数为×100%=5.56%。
[答案] (1)0.075 mol (2)5.56%
14.科学探究是非常注意方法和原则的。往往采用控制条件不变,每次只有一个变量的方式来探究事物变化的规律。
已知气体X2和气体Y2在一定条件下能化合生成气体C,并知C的化学式只有三种可能:分别为XY、X2Y或X3Y。请设计实验(实验装置任选)来确定C的化学式,简述实验过程,分析说明结论。
实验过程:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
结论及分析:
①若实验结果是________,则生成物C的化学式为XY。判断的依据是________________________________________________________________________
________________________________________________________________________。
②若实验结果是________,则生成物C的化学式为X2Y。判断的依据是________________________________________________________________________
________________________________________________________________________。
[解析] 该题为通过实验确定生成物化学式。因为组成元素未知,所以不能定性分析,而需转化成可测控的量进行定量分析。根据反应物和生成物均为气体的特点,运用阿伏加德罗定律,可通过反应过程中体积变化或压强的变化值来确定反应物的物质的量之比,再由原子守恒得出生成物的化学式。
[答案] 方法一 实验及操作:(测定反应前后的数据、容器性能、恢复温度三项全对才可)
分别取同温、同压、等体积(V1)的X2和Y2两种气体充入一恒压、容积可变的密闭容器中,在一定条件下反应完全并恢复到原来温度后,测定容器的容积(V2)
分析及结论:
①若实验结果是:V2=2V1,则生成物C的化学式为XY
判断的依据是:X2+Y2===2XY,反应前后分子数之比是1∶1,根据阿伏加德罗定律可推得以上结论
②若实验结果是:V2=V1,则生成物C的化学式为X2Y
判断的依据是:2X2+Y2===2X2Y,反应前后分子数之比是4∶3,根据阿伏加德罗定律可推得以上结论
方法二 实验及操作:
分别取同温、同压、等体积的X2和Y2两种气体充入一恒容的密闭容器中,并测定容器的压强(p1)在一定条件下反应完全并恢复到原温度后,再测定容器的压强(p2)
分析及结论:
①若实验结果是:p2=p1,则生成物C的化学式为XY
判断的依据是:X2+Y2===2XY,反应前后分子数之比是1∶1,根据阿伏加德罗定律可推得以上结论
②若实验结果是:p2=p1,则生成物C的化学式为X2Y
判断的依据是:2X2+Y2===2X2Y,反应前后分子数之比是4∶3,根据阿伏加德罗定律可推得以上结论
13.某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
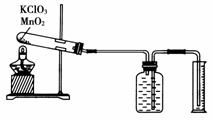
实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL。
⑤准确称量试管和残留物的质量为15.55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同
②使试管和广口瓶内气体都冷却至室温
③读取量筒内液体的体积
这三步操作的正确顺序是________(请填写步骤代码)。
进行③的实验操作时,若仰视读数,则读取氧气的体积______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是________mol;实验测得氧气的摩尔体积是________(保留小数点后两位)。
[解析] (1)往广口瓶中装满水,使装置左侧形成密闭体系,通过捂热试管看广口瓶中长导管液面高度的变化来判断装置气密性。
(2)在测量收集到O2的体积时,先将装置中的气体冷却至室温,否则气体受热膨胀时,会使排出水的体积偏大。然后调整量筒高度,使量筒内液面和广口瓶中液面相平,以保证广口瓶中气体的压强和外界气压相等,从而使排出水的体积与产生O2的体积相等。最后再读取量筒内水的体积。读数时若仰视量筒内的液面,会使读取O2的体积偏小。
(3)根据质量守恒定律,产生O2的质量为15.95 g-15.55 g=0.4 g,n(O2)==0.012 5 mol,
O2的摩尔体积为:=22.38 L/mol。
[答案] (1)往广口瓶中注满水,塞紧橡皮塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气
(2)②①③ 偏小
(3)0.012 5 22.38 L/mol
12.在120 ℃时分别进行如下四个反应:
A.2H2S+O2===2H2O+2S↓
B.2H2S+3O2===2H2O+2SO2
C.C2H4+3O2===2H2O+2CO2
D.C4H8+6O2===4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是________;符合关系式d前=d后和p前=p后的是________(填写反应的代号)。
(2)若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是________;符合d前>d后和V前>V后的是________(填写反应的代号)。
[解析] 本题主要考查阿伏加德罗定律及推论,质量守恒定律等内容。当反应容器体积不变时,(1)由于d=,因此密度的变化要看气体质量的变化,对于反应前后只有气体的反应,根据质量守恒定律,气体的质量反应前后不变,密度也不变,而对于反应物均为气体,反应后生成物有非气体产物时,气体质量会减小,密度也减小。
(2)由于压强与气体的物质的量成正比,因此压强的大小决定于反应前后气体的物质的量。当反应在恒压容器内进行时,由于d=,=,对于反应前后只有气体的反应,应根据气体的物质的量变化推断密度,而对于反应后有非气体产物的反应,可利用同温同压下,气体的密度比等于它们的摩尔质量之比加以判断。本题A选项中,生成物H2O(g)的摩尔质量小于H2S和O2的摩尔质量,因此反应后,平均摩尔质量一定减小,密度也减小。D项由于反应后气体物质的量增加,体积增大,质量不变,密度减小。
[答案] (1)B C (2)D A
11.(1)2 mol O3和3 mol O2的质量之比________,分子数之比________,同温同压的密度之比________,含氧原子数之比________,体积之比________。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2物质的量比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是______,混合气体的平均相对分子质量是______,对氢气的相对密度是________。
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为________,推断的依据为________。
[答案] (1)1∶1 2∶3 3∶2 1∶1 2∶3
(2)1∶3 25% 17.5% 4∶7 40 20 (3)O3F2 阿伏加德罗定律和质量守恒定律
10.(2010年新泰质检)标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A.在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B.25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C.同质量的A、B在非标准状况下,其分子数之比为n∶m
D.相同状况下,同体积的气体A与B的质量之比为m∶n
[解析] 只要在相同条件下气体分子数相同,其物质的量、气体体积必相等,设A、B的相对分子质量为MA和MB,气体密度为ρA和ρB,分子数为NA和NB,其质量为WA和WB。对各选项进行分析:A项中,=,则MA∶MB=m∶n,A正确;B项中,两气体的体积相等,则ρA∶ρB=MA∶MB=m∶n,B错误;C项中,摩尔质量越大,单位质量的分子数目越少,等质量的A、B气体的分子数与其摩尔质量成反比,即NA∶NB=MB∶MA=n∶m,C正确;D项中,同温同压下,同体积的气体分子数相同,故A和B等体积时,WA∶WB=MA∶MB=m∶n,D正确。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com