
题目列表(包括答案和解析)
14.向盐A2B溶液中加入CD2溶液,有沉淀生成,为研究这一化学反应,将两种盐分别配成0.1 mol·L-1溶液进行实验,有关数据如下表(化学式中A、B、C、D分别表示原子或原子团。其相对原子质量分别是:A-23 B-96 C-137 D-35.5):
|
编号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
A2B溶液的体积(mL) |
60 |
60 |
60 |
60 |
60 |
60 |
60 |
|
CD2溶液的体积(mL) |
0 |
20 |
40 |
60 |
70 |
80 |
120 |
|
沉淀质量(g) |
0 |
0.464 |
|
1.395 |
1.402 |
1.397 |
|
试回答下列问题:
(1)用化学方程式(用A、B、C、D代码表示)表示其反应______________________;理由是________________________________________________________________________
____________________________;
(2)沉淀的化学式为________,理由是________________________________________________________________________
________________________________________________________________________;
(3)3号实验中沉淀的质量为________,7号实验中沉淀的质量为____________。
[解析] 从实验情境考虑,第4、5、6三组实验所得的沉淀质量分别为1.395 g、1.402 g、1.397 g,数据误差很小,这种误差,可以看成是沉淀经过滤、洗涤、称量等操作造成的,所以这三组实验中所生成的沉淀质量是相等的。分析实验中所加的A2B、CD2溶液的体积,可看出第4、5、6三组中,A2B物质已反应完;第2、3组中,A2B过量。比较第2、4组实验中所得沉淀质量数据,可得出第4组实验中A2B、CD2两种物质都恰好完全反应,即A2B、CD2的物质的量之比为1∶1时,恰好完全反应。根据实验数据处理方法,求4、5、6三组的平均值来作为这一实验的沉淀质量即1.398 g。由此可求得若1 mol A2B和1 mol CD2恰好完全反应生成沉淀的摩尔质量应为=233 g·mol-1,结合题给相对原子质量可得沉淀必为CB。根据质量守恒定律可得出反应式为:A2B+CD2===2AD+CB↓。第3组实验中,CD2不足,可求得沉淀质量为0.1 mol·L-1×0.04 L×233 g·mol-1=0.932 g。第7组沉淀中,CD2过量,沉淀质量为0.1 mol·L-1×0.06 L×233 g·mol-1=1.398 g。
[答案] (1)A2B+CD2===2AD+CB↓
4号实验后沉淀的量稳定,反应完全,可知反应中n(CD2)∶n(A2B)=1∶1
(2)CB 若为AD,则沉淀的质量=2×0.1 mol·L-1×0.06 L×58.5 g·mol-1=0.702 g,与实验结果不符
(3)0.932 g 1.398 g
13.实验室里需用480 mL 0.5 mol·L-1的NaOH溶液。
(1)该同学应选择________ mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的__________(填选项字母)之间。
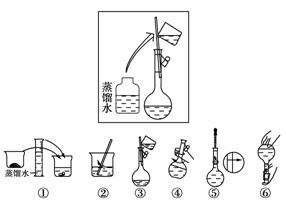
A.②与③ B.①与②
C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
|
|
a |
b |
c |
d |
e |
|
砝码大小/g |
100 |
50 |
20 |
10 |
5 |
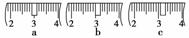
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会__________。
[答案] (1)500 (2)C (3)10.0 c、d c
(4)①偏小 ②无影响
12.已知某饱和NaCl溶液的体积为V mL,密度为ρ g·cm-3,质量分数为w%,物质的量浓度为c mol·L-1,溶液中含NaCl的质量为m g。
(1)用m、V表示溶液的物质的量浓度________。
(2)用w、ρ表示溶液物质的量浓度________。
(3)用c、ρ表示溶液的质量分数________。
(4)用w表示该温度下NaCl的溶解度________。
[解析] (1)c==mol/L
(2)c=
=mol·L-1=mol/L
(3)w%=×100%
=×100%
(4)=,S=
[答案] (1)mol·L-1 (2)mol·L-1
(3)×100% (4)g
11.现有m g某气体,它由四原子分子构成,它的摩尔质量为M g·mol-1。则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数为________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为________。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为________mol·L-1。
[解析] (1)根据n=可得:n==mol。
(2)已知该气体分子为四原子分子,则该气体中所含的原子的物质的量为mol,根据n=可得,该气体所含的原子总数为N=n×NA=mol×6.02×1023mol-1=。
(3)在标准状况下,Vm=22.4 L·mol-1,根据n=可得:V=n×Vm=mol×22.4 L·mol-1=L。
(4)1 L水的质量是:1 000 g。m g该气体溶于1 L水中,所得溶液中溶质的质量分数是:w=×100%=×100%。
(5)V(aq)=V L,则c===mol·L-1。
[答案] (1) (2) (3)
(4)×100% (5)
10.(2010年西安质检)下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此下列说法正确的是(多选)( )
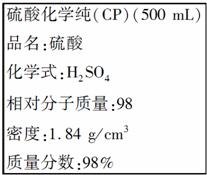
A.该试剂的物质的量浓度为9.2 mol/L
B.配制200 mL 4.6 mol/L的稀H2SO4需50 mL该硫酸
C.配制100 g 10%的H2SO4溶液需要用的仪器有胶头滴管、烧杯、玻璃棒、100 mL量筒、10 mL量筒
D.该H2SO4与等体积水混合后所得溶液的质量分数小于49%
[解析] 根据c==18.4 mol/L,A错误;根据稀释定律c1V1=c2V2,200 mL×4.6 mol/L=V2×18.4 mol/L,V2=50 mL,B正确;C项配制100 g 10%的硫酸需该H2SO4的体积为V==5.5 mL,故选用10 mL量筒,水的质量可换算为体积,用100 mL量筒量取,C正确;由于硫酸的ρ>1,所以w>49%,D错误。
[答案] BC
9.配制250 mL 0.10 mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中进行定容时仰视刻度线
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
[解析] B项,如图乙所示,定容后液面高于容量瓶的刻度线,溶液体积偏大,NaOH物质的量浓度偏小;C项,如图甲所示,情况与B项相反;A、D两项易判断会偏小。
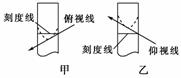
[答案] C
8.使用胆矾配制1 L 0.1 mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水里
B.称取胆矾25 g,溶解在1 L水里
C.将25 g胆矾溶于水,然后将此溶液稀释至1 L
D.将16 g胆矾溶于水,然后将此溶液稀释至1 L
[解析] A、B两项中水为1 L时再溶解了别的物质,形成溶液的体积就不是1 L了,尽管溶质为0.1 mol,但其浓度不是0.1 mol/L;D项中16 g胆矾含CuSO4少于0.1 mol,浓度也不是0.1 mol/L。
[答案] C
7.若以M表示水的摩尔质量,V表示在标准状况下水的摩尔体积,ρ为在标准状况下的密度,NA为阿伏加德罗常数,m、Δ分别表示每个水分子的质量和体积,下面是四个关系式:①NA=Vρ/m,②ρ=M/(NAΔ),③m=M/NA,④Δ=V/NA,其中( )
A.①和②都是正确的 B.①和③都是正确的
C.③和④都是正确的 D.①和④都是正确的
[解析] 由在标准状况下的密度为ρ,摩尔体积为V,可知水的摩尔质量为ρV=M,每个水分子的质量为m,NA个水分子的质量为m·NA,由此可得m·NA=ρV=M,推出①③正确;②④两式错误混淆了水在标准状况下的状态为液体,认为一个水分子的体积为Δ,NA个水分子的体积为NAΔ=V,从而推出错误的关系式为②④。
[答案] B
6.某温度下,V mL不饱和NaNO3溶液a g,蒸发掉b g水或加入b g NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是(多选)( )
A.该温度下NaNO3的溶解度为100 g
B.原不饱和溶液中NaNO3的质量分数为%
C.原不饱和溶液中NaNO3的物质的量浓度为mol/L
D.原不饱和溶液的密度为g/mL
[解析] 由题意,b g水中溶解b g NaNO3达到饱和,即此温度下NaNO3溶解度为100 g,A项正确;此温度下饱和溶液的质量分数为=,所以原溶液中NaNO3的质量为(a-b) g×,则原溶液质量分数为×100%=%,B项错;原溶液的物质的量浓度为÷L=mol/L,C项正确;D项中溶液的密度为= g/mL,D项不正确。
[答案] AC
5.(2010年泉州质检)NA代表阿伏加德罗常数的值,下列叙述错误的是( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2===2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1NH4Cl溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH4+物质的量不同
[解析] A项中硫酸稀释后其密度也大于1 g/mL,因此稀释后100 mL H2SO4的质量分数小于9.8%;B项反应中氧的化合价升高了2价,则每生成32 g氧气,转移2NA个电子;C项CO和C2H4的相对分子质量相等,故无论二者的比例如何,标准状况下的22.4 L气体为1 mol,质量为28 g;D项NH4Cl溶液浓度不同,水解程度不同,因此两种溶液尽管物质的量相同,但所含的NH4+物质的量不同。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com