
题目列表(包括答案和解析)
10.下列关于物质的量浓度表述正确的是( )
A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量0.9 mol·L-1
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.10 ℃时,100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1
[解析] 0.3 mol·L-1的Na2SO4溶液中,含有Na+、SO42-的总浓度为0.9 mol·L-1,但选项中问的是总的物质的量;1 L水吸收22.4 L氨气的氨水浓度不是1 mol·L-1,且22.4 L氨气不知道是否是标准状况,故当氨水体积是1 L时,其浓度也不一定是1 mol·L-1;在K2SO4、NaCl混合液中,当n(Na+)=n(SO42-)时,n(K+)≠n(Cl-),因为在溶液中应满足阴、阳离子的电荷守恒;D选项正确。
[答案] D
9.标准状况下有①0.112 L水;②3.01×1023个氯化氢分子;③13.6 g H2S气体;④0.2 mol氨气,下列对这四种物质的关系由小到大排列正确的是(多选)( )
A.体积:①④③② B.密度:④①③②
C.质量:①④③② D.氢原子数:②④③①
[解析] A项中n(HCl)=0.5 mol,n(H2S)=0.4 mol,故体积关系V(H2O)<V(NH3)<V(H2S)< V(HCl);B项中液态水密度最大,而不是HCl;C项中m(H2O)=112 g,m(HCl)=18.25 g,m(H2S)=13.6 g,m(NH3)=3.4 g,故由小到大顺序为:m(NH3)<m(H2S)<m(HCl)<m(H2O);D项H原子最多的是0.112 L H2O,n(H)=×2=12.4 mol,0.5 mol HCl、0.4 mol H2S、0.2 mol NH3中H原子的物质的量分别为0.5 mol、0.8 mol、0.6 mol,故由小到大顺序为②④③①。
[答案] AD
8.(2010年东阳质检)设阿伏加德罗常数的值为NA,标准状况下某种O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积(V)应是( )
A.22.4nb/mNA L B.22.4mb/nNA L
C.22.4nNA/mb L D.nbNA/22.4m L
[解析] 在标准状况下,m g气体所占体积为:×22.4 L,
则n g气体的体积为××22.4 L= L。
[答案] A
7.如下图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )
①浓硫酸 ②饱和氯化钠溶液 ③亚硫酸钠溶液 ④饱和碳酸氢钠溶液
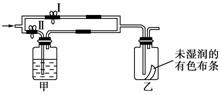
A.①②③ B.②③④
C.①②④ D.①③④
[解析] Cl2与H2O反应生成的HClO具有漂白作用。气体通过甲瓶后不能使布条褪色,可能有两个原因。一是甲瓶中溶液将Cl2干燥,二是甲瓶中溶液将Cl2吸收。浓硫酸吸水,Na2SO3+Cl2+H2O===Na2SO4+2HCl,NaHCO3+Cl2===NaCl+CO2+HClO,所以Cl2经过①被干燥或经过③④被吸收,不能使干燥有色布条褪色。Cl2在饱和NaCl溶液中溶解度很小,故Cl2与水蒸气共同进入乙瓶,使有色布条褪色。
[答案] D
6.下列离子方程式正确的是( )
A.Ca(ClO)2溶液中通入SO2:
Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
B.将Cl2通入水中:
Cl2+H2O===2H++Cl-+ClO-
C.MnO2与浓盐酸共热制Cl2:
MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
D.Cl2通入冷的NaOH溶液中:
2Cl2+2OH-===3Cl-+ClO-+H2O
[解析] 此题是以卤素单质及其化合物为背景的离子方程式的正误判断题。解题的关键是依据:①反应的客观实在性;②电荷守恒;③质量守恒及电子转移守恒等。A项中产物应为CaSO4;B项中HClO为弱电解质,应写分子式;D项中电荷不守恒。
[答案] C
5.同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是(多选)( )
A.体积比1∶1 B.体积比11∶16
C.密度比16∶11 D.密度比11∶16
[解析] 质量相同时===,
同温同压下:V(SO2)∶V(CO2)=n(SO2)∶n(CO2)=11∶16。
ρ(SO2)∶ρ(CO2)=M(SO2)∶M(CO2)=16∶11。
[答案] BC
4.相同体积的两份植物营养液,其配方如下表
|
物质成分的量序号 |
KCl |
K2SO4 |
ZnSO4 |
ZnCl2 |
|
① |
0.3 mol |
0.2 mol |
0.1 mol |
/ |
|
② |
0.1 mol |
0.3 mol |
/ |
0.1 mol |
两份营养液中各自离子的浓度( )
A.完全相同 B.仅c(K+)相同
C.仅c(Cl-)相同 D.完全不同
[解析] 据表中数据可知,两溶液中各离子的物质的量均相同。n(K+)=0.7 mol,n(Cl-)=0.3 mol,n(SO42-)=0.3 mol,n(Zn2+)=0.1 mol。
[答案] A
3.(2010年潍坊抽检)下列关于钠与水反应的说法不正确的是( )
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应时因温度高会发生燃烧
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
A.② B.②③
C.②③④ D.①②③④
[解析] ①中反应后溶液应变蓝,②中钠应先与盐酸反应,③中钠在水蒸气中因无氧气不能燃烧,④中用铝箔包住的钠放出的H2多。
[答案] D
2.往烧杯内注入煤油和水各100 mL,静置后将一小块钠投入烧杯内。发生的现象是( )
A.钠沉到液柱1/2处,熔成小球后,钠球下部有许多气泡放出,附有气泡的钠球徐徐上升到液体上部,一会儿又沉到液柱1/2处,如此反复多次,最后消失
B.钠块一直沉到烧杯底部,并停留在杯底,放出气泡,最后消失
C.钠块浮在液柱表面上,很快熔成一个闪亮的小球,小球四处游动,最后消失
D.钠块沉到液柱1/2处,很快熔成一个闪亮的小球,小球在液柱1/2处沿水平方向迅速游来游去,最后消失
[解析] 因为钠比水轻,比煤油重,最初钠沉在液柱1/2处。由于钠跟下层水反应产生H2,H2的冲力使钠徐徐上升至液柱上部,待H2放出后钠又沉于液柱1/2处,再跟下层水反应再上升,如此反复直到消失。
[答案] A
1.饱和氯水长时间放置后,下列微粒在溶液中的物质的量减少的是( )
①Cl2 ②HClO ③H2O ④HCl ⑤O2
A.①② B.①②③
C.①②④ D.①②⑤
[解析] 饱和氯水长时间放置,次氯酸分解生成氯化氢和氧气。所以氯气分子、次氯酸分子、水分子的物质的量将减少。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com