
题目列表(包括答案和解析)
2.下列有关合成洗涤剂的叙述,错误的是( )
A.在洗涤剂烷基苯磺酸钠中,烷基含碳原子的个数以12-18为宜
B.在洗涤剂烷基苯磺酸钠中,烷基应以带支链为宜
C.在合成洗涤剂中添加酶制剂可提高洗涤效果
D.在合成洗涤剂中应以无磷助剂代替含磷助剂
[答案] B
1.普钙是目前使用最广泛的磷肥,其主要成分是( )
A.Ca5(PO4)3F B.Ca(H2PO4)2和CaSO4
C.Ca3(PO4)2和CaHPO4 D.CaHPO4和Ca(H2PO4)2
[答案] B
17.(12分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用如图所示中的实验装置进行实验,证明过氧化钠可作供氧剂。
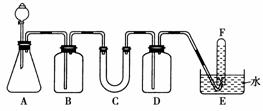
(1)A是制取CO2的装置。写出A中发生反应的化学方程式
________________________________________________________________________。
(2)填写表中空格
|
仪器 |
加入试剂 |
加入该试剂的目的 |
|
B |
饱和NaHCO3溶液 |
|
|
C |
|
|
|
D |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式________________________________________________________________________
__________________________。
(4)试管F中收集满气体后,下一步实验操作是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[解析] 实验室用大理石(CaCO3)与稀盐酸(HCl)反应来制备CO2,其反应方程式:CaCO3+2HCl===CaCl2+H2O+CO2↑,因生成的CO2气体中含有HCl气体杂质,通过装置B中的饱和NaHCO3溶液将其除去:NaHCO3+HCl===NaCl+CO2↑+H2O。将除去HCl的气体通过装有Na2O2的装置C从而生成O2;2Na2O2+2CO2===2Na2CO3+O2,2H2O+2Na2O2===4NaOH+O2↑。因生成的O2中含有在水中溶解度比较小的CO2,会影响O2的检验,故在收集O2之前应用NaOH溶液将其除去,可见装置D中应加入NaOH溶液。
[答案] (1)CaCO3+2HCl===CaCl2+H2O+CO2↑
(2)
|
仪器 |
加入试剂 |
加入该试剂的目的 |
|
B |
饱和NaHCO3溶液 |
除去CO2气体中混入的HCl |
|
C |
过氧化钠 |
与CO2和水气反应,产生O2 |
|
D |
NaOH溶液 |
吸收未反应的CO2气体 |
(3)2Na2O2+2CO2===2Na2CO3+O2
(4)把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气
2.(2)BCF
(3)0 大于 小于
(4)13.6 15 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌
16.(13分)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。
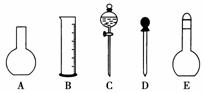
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 0.1 mol·L-1。
(4)根据计算可知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________________________________________________________________。
[解析] (1)五种仪器分别为烧瓶、量筒、分液漏斗、胶头滴管、容量瓶,配制上述溶液肯定不需要烧瓶和分液漏斗,还需要烧杯、玻璃棒。
(2)容量瓶不能用于贮存、加热溶液,它只有一个刻度线,也不能测量容量瓶规格以下的任意体积的液体。
(3)因无480 mL的容量瓶配制NaOH溶液常用500 mL的容量瓶,m(NaOH)=c·V·M=0.1 mol/L×0.5 L×40 g/mol=2.0 g,定容俯视刻度线,造成加水较少,浓度偏高,洒落溶液会造成溶液浓度偏低。
(4)由稀释前后物质的量相等,V(浓)== L= L=13.6 mL,选用15 mL量筒最好,误差小。稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌。
[答案] (1)AC 烧杯、玻璃棒
15.(9分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
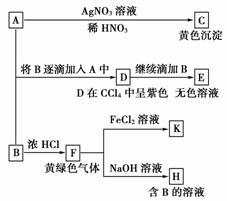
请回答:
(1)写出A、B和C的化学式:A________,B________,
C________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
________________________________________________________________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
________________________________________________________________________。
(4)写出由F→H的化学方程式:
________________________________________________________________________。
[答案] (1)NaI NaClO AgI
(2)2I-+ClO-+H2O===I2+Cl-+2OH-
I2+5ClO-+2OH-===2IO3-+5Cl-+H2O
(3)2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
(4)Cl2+2NaOH===NaClO+NaCl+H2O
14.(9分)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是____________。
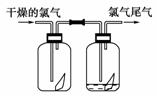
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用________溶液吸收多余的氯气,原理是(用化学方程式表示)
________________________________________________________________________。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是________(填化学式),长期露置于空气中已完全失效的漂白粉,加稀盐酸后产生的气体是________(用字母代号填)。
A.O2 B.Cl2
C.CO2 D.HClO
(3)据“北方网”报道,2004年4月15日到16日,位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故。截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是________。
A.NaOH B.NaCl
C.KBr D.Na2CO3
[答案] (1)干燥布色不褪色,潮湿布条褪色
(2)NaOH Cl2+2NaOH===NaCl+NaClO+H2O Ca(ClO)2 C
(3)D
13.(9分)(1)0.3 mol NH3分子中所含质子数与________个H2O分子中所含质子数相等。
(2)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是______________。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为________。
(4)2.3 g Na中含________mol e-,在跟足量水反应中失去________mol e-。
(5)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数的值)________。
[答案] (1)1.806×1023 (2)0.6 mol (3)106 g·mol-1 (4)1.1 0.1 (5)
12.(2010年济南质检)“假说”在化学科学的研究和发展中起着重要的作用。下列“假说”在化学科学发展过程中曾经起到一定的作用,从目前的化学理论看,仍然合理的是( )
A.道尔顿提出的“每一元素的原子以其原子质量为其特征,原子是不可分的”
B.阿伦尼乌斯提出的“电解质在水溶液中能离解成带电的粒子”
C.贝采里乌斯提出的“不同原子带不同的电性,因而产生吸引力,由此形成化合物”
D.盖·吕萨克提出的“在同温同压下,相同体积的不同气体含有相同数目的原子”
[解析] 从目前化学理论看,每一元素的原子以其中子数(即原子质量)为其特征,原子可以再分,故A项不符合题意。目前化学理论认为,原子呈电中性,原子间通过化学键形成化合物,故C项不符合题意。同温同压下,相同体积的不同气体应含有相同数目的分子,而不是原子,D项不符合题意。
[答案] B
11.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的(同温同压),这时混合气体中N2、O2、CO2的物质的量之比为( )
A.3∶4∶1 B.3∶3∶2
C.6∶7∶3 D.6∶9∶0
[解析] 同温同压下,体积和物质的量成正比关系,设N2、O2、CO2各为3 mol,由于气体反应前为9 mol,反应后为8 mol。
2Na2O2+2CO2===2Na2CO3+O2 气体物质的量之差
2 mol 1 mol 1 mol
所以反应后的气体n(N2)=3 mol,n(O2)=4 mol,n(CO2)=1 mol,即N2、O2、CO2的物质的量之比为:3∶4∶1。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com