
题目列表(包括答案和解析)
2.精制食盐水时下列物质中,不必用到的有( )
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
A.③④⑤ B.③⑤⑦
C.②⑤⑥ D.②④⑤⑦
[解析] 精制食盐水时要除去粗盐水中的Ca2+、Mg2+、SO42-分别用到的试剂为Na2CO3、NaOH、BaCl2,最后再加盐酸除多余的CO32-、OH-。
[答案] B
1.目前下列工艺过程没有直接使用离子交换技术的是( )
A.硬水的软化 B.电解饱和食盐水制造NaOH
C.电渗析淡化海水 D.海水中提取金属Mg
[解析] A项中离子交换法使用了离子交换树脂;B项中通常选用石棉隔膜,可阻止气体通过,而不阻止水分子和离子通过;C项,通常选用阴、阳离子交换膜;只有D项没直接使用离子交换技术。
[答案] D
10.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
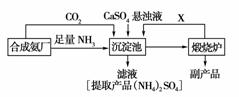
请回答以下问题:
(1)合成氨反应的化学方程式是________________________。沉淀池中发生的主要反应方程式是__________________________________________。该反应能够发生的原因是______________________________________。
(2)在上述流程的沉淀池中通入足量氨气的目的是________
________________________________________________________________________,
可以循环使用的X是________。
(3)该生产过程中的副产品是________,从绿色化学和资源综合利用的角度说明上述流程的主要优点是______________________________;从物质的性质和工业生产实际的角度考虑该流程的主要缺陷是________________________________。
[解析] 根据反应CaSO4+CO2+2NH3+H2O===CaCO3↓+(NH4)2SO4和平衡原理可知,生成的CaCO3溶解度小于CaSO4,有利于反应正向进行,溶液呈碱性有利于CO2的吸收,所以通入足量氨气;根据流程判断可知循环的气体X是CO2,副产品是生石灰。
[答案] (1)N2+3H2 2NH3 CaSO4+CO2+2NH3+H2O===CaCO3↓+(NH4)2SO4 生成的CaCO3溶解度小于CaSO4,有利于反应正向进行
2NH3 CaSO4+CO2+2NH3+H2O===CaCO3↓+(NH4)2SO4 生成的CaCO3溶解度小于CaSO4,有利于反应正向进行
(2)一方面提供反应物,另一方面使溶液呈碱性有利于CO2的吸收 CO2
(3)生石灰 该流程中,产生的CO2循环使用,得到的产品和副产品都是有用物质,无废物产生 由于CaSO4溶解度小,此反应的产率比较低
9. 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:________________________________________________________________________;
(2)写出“联合制碱法”有关反应的化学方程式:________________________________________________________________________
________________________________________________________________________;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________________________________________________________________________
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:
原子利用率(%)=________________________________________________________________________。
[解析] 氨碱法的原料:氯化钠、碱酸钙及NH3。
工艺流程:CaCO3CaO+CO2↑
CO2+NH3+H2O===NH4HCO3
NaCl+NH4HCO3===NaHCO3↓+NH4Cl
2NaHCO3Na2CO3+H2O↑+CO2↑
CaO+H2O===Ca(OH)2
产生CaCl2的反应:Ca(OH)2+2NH4Cl===CaCl2+2NH3↑+2H2O,该反应的CaCl2中的Cl-来源于NaCl,Ca2+来源于CaCO3,产生无用的CaCl2,降低了NaCl的利用率。
联合制碱法:NH3和CO2来源于合成氨厂
工艺流程:NH3+CO2+H2O===NH4HCO3
NaCl+NH4HCO3===NaHCO3↓+NH4Cl
2NaHCO3Na2CO3+H2O↑+CO2↑

依据总反应:
2NaCl+CO2+H2O+2NH3===Na2CO3+2NH4Cl
可得:原子利用率=×100%=49.77%。
[答案] (1)2NH4Cl+Ca(OH)2===2NH3↑+CaCl2+2H2O
(2)NH3+CO2+H2O===NH4HCO3;
NaCl+NH4HCO3===NaHCO3↓+NH4Cl;
2NaHCO3Na2CO3+H2O↑+CO2↑
(3)“联合制碱法”中的CO2来源于合成氨厂,“氨碱法”中的CO2来源于石灰石
(4)×100%=49.77%
8.将磷肥生产过程中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论在经济效益、资源综合利用还是保护环境方面都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
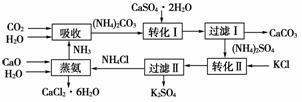
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等。
(2)石膏悬浊液中加入碳酸铵溶液后反应的离子方程式为________________________________________________________________________
。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液,但很容易混有(NH4)2CO3。检验滤液中是否含有CO32-的方法是:__________________________。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,是因为________(选填序号)。
a.熔点较低(29 ℃熔化) b.能导电
c.能制冷 d.无毒
[解析] (1)从石膏转化为硫酸钾和氯化钙的工艺流程示意图可以看出,所用的原料除CaSO4·2H2O、KCl外,还需要CaO、NH3、H2O、CO2等,CaO、CO2可由CaCO3煅烧得到。
(2)写离子方程式时石膏悬浊液应写为分子式,离子方程式为CaSO4+CO32-===CaCO3↓+SO42-。
(3)由于CaSO4微溶,过滤Ⅰ操作所得固体中,除CaCO3外还含有CaSO4。
(4)此题中检验CO32-可滴加盐酸看是否产生气泡。
(5)物质的三态变化要吸收或放出热量,能实现热量的储存或释放,无机储热材料往往具有熔点低和无毒的特点。
[答案] (1)CaCO3、NH3、H2O (2)CaSO4+CO32-===CaCO3↓+SO42- (3)CaSO4 (4)向滤液中滴加盐酸看是否产生气泡 (5)ab
7.硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+O2(g)  2SO3(g) ΔH=-98.3
kJ·mol-1
2SO3(g) ΔH=-98.3
kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
________________________________________________________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
________________________________________________________________________
________________________________________________________________________。
[解析] (2)根据化学平衡原理来确定的条件改变是D项(增大反应物浓度,使平衡正向移动)。
根据化学平衡原理,降温有利于平衡正向移动,保持适宜温度是为了使催化剂效率最高。
(3)转化率为95%+(1-95%)×95%=99.75%。
(4)注意SO2用NH3吸收后再用H2SO4处理,可得相应化肥。SO2可以再次循环利用。
[答案] (1)硫酸铵(或硫酸钾或过磷酸钙等) (2)D
(3)99.75% (4)①SO3从吸收塔底部进入,吸收剂(浓硫酸)从顶部下淋,形成对流
②SO2+NH3+H2O===NH4HSO3;2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑
[或SO2+2NH3+H2O===(NH4)2SO3;(NH4)2SO3+H2SO4===(NH4)2SO4+H2O+SO2↑]
6.与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是( )
A.提高了原料的原子利用率 B.降低了生产成本
C.减少了环境污染 D.减轻了对设备的腐蚀
[解析] 联合制碱法把合成氨和纯碱两种产品联合生产,提高了食盐利用率,缩短了生产流程,减少了对环境污染。
[答案] D
5.合成氨时既要提高产率,又要使反应速率加快,可采取的办法是( )
①减压 ②加压 ③升温 ④降温 ⑤及时从平衡混合物中分离出氨气 ⑥补充N2和H2 ⑦加催化剂 ⑧减少N2或H2的量
A.③④⑤⑦ B.②⑤⑥
C.②⑥ D.②③⑥⑦
[解析] ①正确理解化学平衡移动原理的含义,②要考虑实际生产的可行性和综合经济效益。
合成氨反应的特点是正反应是放热且气体体积减小,要使平衡向正反应方向移动且反应速率加快,应选B。
[答案] B
4.下列有关硫铁矿制硫酸的说法中,正确的是( )
A.沸腾炉中出来的炉气,可直接进入转化器中进行催化氧化
B.焙烧硫铁矿的反应中,二氧化硫是唯一的氧化产物
C.生产过程中要采用高温高压,以有利于二氧化硫更好地转化为三氧化硫
D.三氧化硫在吸收塔中被吸收时,通常用质量分数为98.3%的硫酸做吸收剂,而不直接用水吸收
[解析] 考查硫酸的生产工艺流程原理。沸腾炉中出来的炉气除了含有SO2、O2、N2外还有水蒸气及其他杂质,水蒸气和杂质对设备和下一步进行的氧化反应有害,因此必须进行净化和干燥处理,故A错误。FeS2被氧化,氧化产物为SO2和Fe2O3,故B错误。高温对反应速率有利,但对转化率不利;高压虽然对二者皆有利,但实践证明常压下二氧化硫转化率已经很高,故C错误。用质量分数98.3%的硫酸做吸收剂,可以防止形成酸雾提高二氧化硫的吸收率,故D正确。
[答案] D
3.有关硫酸工业综合经济效益的说法中正确的是( )
A.甲地有丰富的硫铁矿资源,水源能源充足,交通便利,是风景秀丽的旅游胜地,虽当地使用硫酸的工业不多,但为提高当地经济效益宜建硫酸厂
B.为减少SO2对空气的污染,可以建筑高烟囱,使含SO2的尾气在高空扩散稀释,到达地面时达到安全浓度
C.硫酸生产过程排放的污染物主要是含SO2的尾气、固体烧渣、废酸和废水等
D.选择硫酸厂厂址时,当经济利益与环保问题有冲突时,为提高人们的物质生活水平,应先考虑经济利益的问题
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com