
题目列表(包括答案和解析)
8.(1)配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
①请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3 ,
CoCl3·5NH3 ,
CoCl3·4NH3(绿色和紫色): 。
②后两种物质组成相同而颜色不同的原因是______________。
③上述配合物中,中心离子的配位数都是________。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN===Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合。请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供__________,SCN-提供____________,二者通过配位键结合。
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1∶1配合所得离子显血红色。含该离子的配合物的化学式是______________。
③若Fe3+与SCN-以个数比1∶5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为______________________________。
[解析] (1)由题意知,四种络合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl。最后两种应互为同分异构体。
(2)Fe3+和SCN-形成配合物时,Fe3+提供空轨道,SCN-提供孤对电子,Fe3+和SCN-以1∶1和1∶5形成络离子时写化学式要用Cl-和K+分别平衡络离子的电荷,使络合物呈电中性。
[答案] (1)①[Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2
[Co(NH3)4Cl2]Cl ②它们互为同分异构体 ③6
(2)①空轨道 孤电子对 ②[Fe(SCN)]Cl2 ③FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl
7.有下列微粒:
①CH4 ②CH2 CH2 ③CH
CH2 ③CH CH ④NH3 ⑤NH4+
CH ④NH3 ⑤NH4+
⑥BF3 ⑦P4 ⑧H2O ⑨H2O2
填写下列空白(填序号):
(1)呈正四面体的是________。
(2)中心原子轨道为sp3杂化的是________,为sp2杂化的是________,为sp杂化的是________。
(3)所有原子共平面的是________,共线的是________。
(4)微粒存在配位键的是________。
(5)含有极性键的极性分子是________。
[解析] CH4、NH3、NH4+、P4、H2O、H2O2中心原子最外层各有四对电子,为sp3杂化,其空间构型分别为正四面体、三角锥、正四面体、正四面体、V形、二面角形。BF3、CH2 CH2的中心原子为sp2杂化,分别为平面三角形、平面形。CH
CH2的中心原子为sp2杂化,分别为平面三角形、平面形。CH CH中心原子为sp杂化,直线形。存在配位键的为NH4+,结构式为
CH中心原子为sp杂化,直线形。存在配位键的为NH4+,结构式为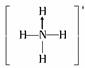 。
。
[答案] (1)①⑤⑦ (2)①④⑤⑦⑧⑨ ⑥② ③
(3)②③⑥ ③ (4)⑤ (5)④⑧⑨
6.下列说法中错误的是(多选)( )
A.卤化氢中,以HF沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水中氢键键能大
D.氢键X-H…Y的三个原子总在一条直线上
[解析] 本题考查了氢键对物质性质的影响以及氢键的存在。因HF存在氢键,所以沸点HF>HBr>HCl,A正确;邻羟基苯甲醛的分子内羟基与醛基之间存在氢键,而对羟基苯甲醛的氢键只存在于分子间,所以对羟基苯甲醛的熔、沸点高,B正确;据F原子半径小于O原子半径,可知(HF)n中氢键键长比水中氢键键长短,键能大,但由于一个HF分子只能与两个相邻的HF分子形成氢键,而一个H2O分子可与四个相邻的H2O分子形成氢键,故水的沸点比HF的沸点高,C项不正确;氢键有方向性,但氢键的形成不像共价键对方向的要求那么高,故X-H…Y不一定总在一条直线上,D不正确。
[答案] CD
5.下列叙述中正确的是( )
A.离子化合物中不可能存在非极性键
B.非极性分子中不可能既含极性键又含非极性键
C.非极性分子中一定含有非极性键
D.不同非金属元素原子之间形成的化学键都是极性键
[解析] 判断“不可能存在”“一定含有”“都是”等类结论的正误时,一般可用反例法。即只要能举出一个可以成立的反例来,则可否定题中结论,如果不存在反例,则可认为题中结论正确。
A项离子化合物中可能存在非极性键。如Na2O2是离子化合物,其中O-O键是非极性键,故A错误。
B项非极性分子中,既含非极性键又含极性键是可能的。如乙烯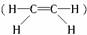 分子中,C--H键是极性键,C==C键是非极性键。
分子中,C--H键是极性键,C==C键是非极性键。
C项由极性键组成的多原子分子,只要分子结构对称就是非极性分子。如CO2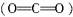 是非极性分子,分子中所有化学键都是极性键,故C也是错误的。
是非极性分子,分子中所有化学键都是极性键,故C也是错误的。
D项叙述正确。因为不同非金属原子吸引电子的能力不同,它们之间的共用电子对必偏向其中一方而形成极性共价键。
[答案] D
4.NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
A.NH3分子是极性分子
B.分子内3个N-H键的键长相等,键角相等
C.NH3分子内3个N-H键的键长相等,3个键角都等于107.3°
D.NH3分子内3个N-H键的键长相等,3个键角都等于120°
[解析] A选项:NH3为极性分子不能说明NH3一定为三角锥形,B三条N-H键键能与键长分别相同,键角相等仍有可能为正三角形,D选项与事实不符。
[答案] C
3.(海南高考)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
[解析] 由石墨的晶体结构知C原子为sp2杂化,故B原子也为sp2杂化,但由于B(OH)3中B原子与3个羟基相连,羟基间能形成氢键,故同层分子间的主要作用力就为氢键。
[答案] C
2.用价层电子互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
[解析] 据价电子对互斥理论可知,H2S分子中S原子采用不等性sp3杂化,除两对孤对电子外,对外的两个杂化轨道分别与一个H原子的各一个1s轨道重叠成键,呈V形结构;BF3分子中B原子采用sp2杂化,三个sp2杂化轨道分别与三个F原子的各一个2p轨道重叠成键,呈平面三角形结构。
[答案] D
1.下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③ B.③④⑤⑥
C.①③⑥ D.③⑤⑥
[解析] 单键均为σ键,双键和三键中各存在一个σ键,其余均为π键。
[答案] D
12.根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2 080 |
4 000 |
6 100 |
9 400 |
|
R |
500 |
4 600 |
6 900 |
9 500 |
|
S |
740 |
1 500 |
7 700 |
10 500 |
|
T |
580 |
1 800 |
2 700 |
11 600 |
|
U |
420 |
3 100 |
4 400 |
5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R B.S和T
C.T和U D.R和T
E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+ B.R2+
C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____。
A.硼 B.铍
C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:__________________________,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第________个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是________________________________________________________________________
________________________________________________________________________。
[解析] (1)由表中数据知,R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族。
(2)离子的氧化性最弱,即其对应的电离能最小。由表中数据看出U的第一电离能为420 kJ·mol-1,数值最小。
(3)Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素。
(4)相邻两个电离能数据相差较大,从一个侧面说明电子是分层排布的,且各能层能量不同。若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在ⅠA族,则第二次电离能飞跃是在失去第10个电子时发生的。
(5)R元素第二电离能有较大飞跃,S元素第三电离能有较大飞跃,T元素第四电离能有较大飞跃,由题意知三者为同周期三种主族元素,可推知R在ⅠA族,S在ⅡA族,T在ⅢA族,故原子序数R<S<T,由表中数据知S元素的电离能异常高,其原因是S元素的最外层电子处于s能级全充满状况,能量较低,比较稳定,失去一个电子吸收的能量较多。
[答案] (1)E (2)D (3)C
(4)电子分层排布,各能层能量不同 10
(5)R<S<T S S元素的最外层电子处于s能级全充满状态,能量较低,比较稳定,失去一个电子吸收的能量较多
11.已知元素周期表中共有18纵行,如图实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自按构造原理最后填入的电子的能级符号。
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影 和
和 表示d区和ds区。
表示d区和ds区。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在________区。
(3)请在元素周期表中用元素符号标出4s轨道半充满的元素。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)随着科学技术的发展,不断有新的元素被发现。若把第七周期排满,则元素周期表共可以排布________种元素。
[答案] (1)如下图
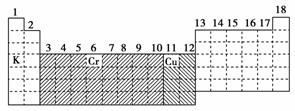
(2)ds (3)见上表
(4)Fe价电子的排布式为3d64s2,Fe2+为3d6,Fe3+为3d5,依据“能量相同的轨道处于全空、全充满和半充满时能量最低”的原则,3d5处于半充满状态,结构更稳定,故Fe3+比Fe2+稳定 (5)118
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com