
题目列表(包括答案和解析)
7.下列物质:①水晶 ②冰醋酸 ③氧化钙 ④白磷 ⑤晶体氩⑥氢氧化钠 ⑦铝 ⑧金刚石 ⑨过氧化钠 ⑩碳化钙 ⑪碳化硅 ⑫干冰 ⑬过氧化氢
(1)属于原子晶体的化合物________。
(2)直接由原子构成的晶体________。
(3)直接由原子构成的分子晶体________。
(4)由极性分子构成的晶体是________,含有非极性键的离子晶体是________,属于分子晶体的单质是________。
(5)在一定条件下能导电而不发生化学变化的是__________,受热熔化后化学键不发生变化的是________,受热熔化时需克服共价键的是________。
[解析] 属于原子晶体的是:金刚石、碳化硅和水晶;属于分子晶体的有:氩(无化学键)、白磷(非极性分子)、干冰(极性键构成的非极性分子)、过氧化氢和冰醋酸(由极性键和非极性键构成的极性分子);属离子晶体的有:CaO(离子键)、NaOH(既存在离子键又存在极性键)、Na2O2和CaC2(既存在离子键又存在非极性共价键);铝属于金属晶体。
金属导电过程不发生化学变化。晶体熔化时,分子晶体只需克服分子间作用力,不破坏化学键,而原子晶体、离子晶体、金属晶体熔化需破坏化学键。
[答案] (1)①⑧⑪ (2)①⑤⑧⑪ (3)⑤ (4)②⑬ ⑨⑩
④⑤ (5)⑦ ②④⑤⑫⑬(氩晶体中无化学键) ①⑧⑪
6.
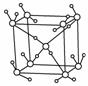
下列说法正确的是( )
A.在固态CO2晶体中,每个CO2分子周围有12个与之紧邻等距的CO2分子
B.如右图所示为冰的一种骨架形式,依此为单位向空间延伸,该冰中的每个分子有6个氢键
C.冰融化时破坏了H-O键
D.原子晶体CO2的晶胞结构与分子晶体CO2的晶胞结构相同
[解析] A项,可以想像,干冰晶体中,所示图形的周围紧密堆着许多正方体-每个面和棱上都连着1个,共计个数:6+12=18。
选取某个顶点上的CO2分子为研究对象,则离它最近的CO2是与它相连的每个侧面中的CO2分子。以该CO2分子为中心沿x、y、z平面分别进行切割得如下图所示三个平面:
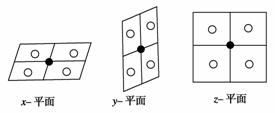
●:被选定的CO2分子
○:离被选定的CO2分子最近的CO2分子
B项,每个水分子与四个方向的其他4个水分子形成氢键,因此每个水分子具有的氢键个数为4×1/2=2。
C项,冰为分子晶体,分子之间存在着范德华力和氢键,在冰融化成水时,它们被破坏,而H2O分子内部的H-O不变。
D项,原子晶体CO2可类比SiO2,晶胞应与SiO2晶胞相同,而不同于干冰晶胞。
由此可知答案。
[答案] A
5.
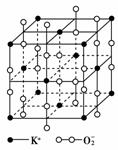
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
[解析] 由题中的晶胞结构知:有8个K+位于顶点,6个K+位于面心,则晶胞中含有的K+数为+=4(个);有12个O2-位于棱上,1个O2-处于中心,则晶胞中含有O2-数为:12×+1=4(个),所以超氧化钾的化学式为KO2;晶体中每个K+周围有6个O2-,每个O2-周围有6个K+,晶体中与每个K+距离最近的K+有12个。
[答案] A
4.下列物质的熔沸点高低顺序中,正确的是(多选)( )
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.MgO>H2O>O2>N2
D.金刚石>生铁>纯铁>钠
[解析] 对于A选项,同属于原子晶体,熔沸点高低主要看共价键的强弱,显然对键能而言,晶体硅<碳化硅,错误;B选项,同为组成、结构相似的分子晶体,熔沸点高低要看相对分子质量大小,正确;C选项,对于不同晶体类型熔沸点高低一般为:原子晶体>离子晶体>分子晶体,MgO>(H2O、O2、N2),H2O>O2>N2,正确;D选项,生铁为铁合金,熔点要低于纯铁,错误。
[答案] BC
3.下表给出几种氯化物的熔点和沸点:
|
|
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
|
熔点/°C |
801 |
714 |
190 |
-70 |
|
沸点/°C |
1 413 |
1 412 |
180 |
57.57 |
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体。其中与表中数据一致的是( )
A.①② B.②
C.①②④ D.②④
[解析] 氯化铝的熔、沸点都很低,其晶体应该是分子晶体,并且沸点比熔点还低,加热时容易升华;四氯化硅是共价化合物,并且熔、沸点很低,应该属于分子晶体;氯化钠是离子晶体。
[答案] A
2.
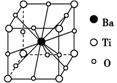
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的结构示意图为如右图所示,它的化学式是( )
A.BaTi8O12 B.BaTi4O6
C.BaTi2O4 D.BaTiO3
[解析] 仔细观察钛酸钡晶体结构示意图可知:Ba在立方体的中心,完全属于该晶胞;Ti处于立方体的8个顶点,每个Ti为与之相连的8个立方体所共用,即只有1/8属于该晶胞;O处于立方体的12条棱的中点,每条棱为四个立方体共用,故每个O只有1/4属于该晶胞。即晶体中N(Ba)∶N(Ti)∶N(O)=1∶(8×1/8)∶(12×1/4)=1∶1∶3。
[答案] D
1.下列叙述中,正确的是( )
A.具有规则几何外形的固体一定是晶体
B.晶体与非晶体的根本区别在于是否具有规则的几何外形
C.具有各向异性的固体一定是晶体
D.依据构成微粒的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
[解析] 晶体与非晶体的根本区别在于其内部微粒在空间是否按一定规律做周期性重复排列。晶体所具有的规则的几何外形、各向异性和特定的对称性是其内部微粒规律性排列的外部反映,因此B错。有些人工加工而成的固体也具有规则的几何外形和高度对称性,但具有各向异性的固体一定是晶体,所以A错,C正确。晶体划分为金属晶体、离子晶体、分子晶体、原子晶体是依据构成晶体的微粒及微粒间的相互作用来进行分类的,因此D错。
[答案] C
11.元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)确定X、Y两种元素在周期表中的位置。
________________________________________________________________________。
(2)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式________;该分子中中心原子以sp2杂化,是__________分子,分子构型________。
(3)写出X的质量分数为60%的化合物的化学式__________;该分子中中心原子以sp2杂化,是________分子,分子构型________。
(4)由元素氢、X、Y三种元素形成的化合物常见的有两种,其水溶液均呈酸性,试分别写出其分子式________、________,并比较酸性强弱:________________。
[名师解析] 根据氢化物化学式H2X,知×100%=88.9%,M(X)=16。可推知,X的相对原子质量为16,则Y为S,则其氧化物分别SO2、SO3,根据杂化轨道理论易确定其分子构型、极性。三种元素组成的化合物为H2SO3、H2SO4,由无机含氧酸的判断知酸性:H2SO4>H2SO3。
[答案] (1)X:第2周期、ⅥA族;Y:第3周期,ⅥA族
(2)SO2 极性 Ⅴ形 (3)SO3 非极性 平面三角形
(4)H2SO3 H2SO4 H2SO4>H2SO3
10.(2009年山东高考)C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式__________________。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为____________。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为________,微粒间存在的作用力是________。
(3)氧化物MO的电子总数与SiC的相等,则M为__________(填元素符号)。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键。________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
。
[解析] (1)根据基态原子核外电子排布的规律去写;在C、Si和O元素中,吸引电子的能力由强到弱的顺序是O>C>Si。
(2)在SiC晶体结构中,每个C原子与Si原子形成四个完全相同的C-Si键,所以C原子的杂化方式为sp3杂化。微粒间存在的作用力是共价键。
(3)SiC的电子总数为20,所以M的电子数为(20-8)=12个。故M为Mg。
(4)π键是由p-p轨道肩并肩重叠而形成的,且π键强弱与重叠的程度成正比。而Si原子的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成稳定的π键。
[答案] (1)1s22s22p63s23p2 O>C>Si
(2)sp3 共价键
(3)Mg
(4)C的原子半径较小,C、O原子能充分接近,p-p轨道肩并肩重叠程度较大,形成较稳定的π键。Si的原子半径较大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
9.(2009年宁夏高考有改动)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________________,该元素的符号是________;
(2)Y元素原子的价层电子的轨道表示式为________________,该元素的名称是________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[解析] (1)因为X原子4p轨道上有3个未成对电子,可知其电子排布式为:1s22s22p63s23p63d104s24p3并推出其元素符号为As。
(2)根据Y元素的最外层2p轨道上有2个未成对电子,Y和Z元素的原子序数之和为42-33=9,Y可能为1s22s22p2或1s22s22p4,再根据Z可形成负一价离子,推出Y电子排布为后者,电子排布图为
|
↑↓ |
2s
|
↑↓ |
↑ |
↑ |
2p
,元素名称为氧。Z为氢。
(3)X与Z形成的化合物为AsH3,其空间构型可类比同主族的氢化物NH3,为三角锥形。
(4)氢化物的稳定性和元素的非金属性有关,或与共价键的键长有关。键长越短,键能越大,氢化物越稳定。所以NH3>PH3>AsH3。
[答案] (1)1s22s22p63s23p63d104s24p3 As
(2)
|
↑↓ |
2s
|
↑↓ |
↑ |
↑ |
2p
或
|
↑↓ |
2s
|
↑↓ |
↑ |
↑ |
2p
氧
(3)三角锥形
(4)稳定性:NH3>PH3>AsH3,因为键长越短,键能越大,化合物越稳定。
沸点:NH3>AsH3>PH3,NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com