
题目列表(包括答案和解析)
15.(12分)(2010·北京高考)某氮肥厂氨氮废水中的氮元素多以NH和NH3·H2O的形式存在,该废水的处理流程如下:
过程Ⅱ:在微生物作用的条件下,NH经过两步反应被氧化成NO.两步反应的能量变化示意图如下:
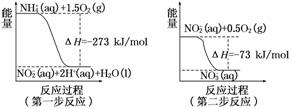
(1)第一步反应是________反应(选填“放热”或“吸热”),判断依据是________.
(2)1 mol NH(aq)全部氧化成NO(aq)的热化学方程式是________________________.
解析:(1)第一步反应中反应物总能量大于生成物总能量,为放热反应.(2)根据盖斯定律,由第一步反应+第二步反应可得:NH(aq)+2O2(g)NO(aq)+2H+(aq)+H2O(l) ΔH=(-273 kJ/mol)+(-73 kJ/mol)=-346 kJ/mol.
答案:(1)放热 反应物的总能量大于生成物的总能量
(2)NH(aq)+2O2(g)2H+(aq)+NO(aq)+H2O(l);
 ΔH=-346 kJ/mol
ΔH=-346 kJ/mol
14.(18分)下表中的数据是破坏1 mol物质中的化学键时所消耗的能量(kJ):
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答(1)-(6)题.
(1)下列物质本身具有的能量最低的是________.
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是________.
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是________反应(填“吸热”或“放热”).
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,若消耗等物质的量的氢气时,放出或吸收热量最多的是________.
(5)若无上表中的数据,你能正确回答出问题(4)吗?
________.你的根据是_____________________________________________________.
(6)写出H2和Cl2反应的热化学方程式:_____________________________________
________________________________________________________________________.
解析:破坏1 mol物质时的化学键所消耗的能量与相同条件下由形成该物质的两原子形成1 mol该物质放出的能量相等,放出的能量越多,物质本身具有的能量越低,分子越稳定.
(1)生成1 mol H2时放出的能量最多,为436 kJ.
(2)生成1 mol HCl时放出的能量最多,为432 kJ.
(3)分别计算出三个反应放出的热量依次为:185 kJ、103 kJ和9 kJ.
答案:(1)A (2)A (3)放热 (4)Cl2
(5)能 生成物越稳定,放出的热量越多,在HX中,HCl最稳定
(6)H2(g)+Cl2(g)===2HCl(g);ΔH=-185 kJ/mol
13.(8分)(2011·西城模拟)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是________________________________________________.
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ/mol
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ/mol
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ/mol
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)===CO(g)+H2(g);ΔH=________ kJ/mol.
解析:(1)根据提供信息,1 mol甲烷完全燃烧生成液态水放出890.31 kJ的热量,因此其热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31 kJ/mol.
(2)设提供的三个反应分别为①、②、③,根据盖斯定律,C(s)+H2O(g)===CO(g)+H2(g)可以通过①-②-③得到,因此该反应的ΔH=-437.3 kJ/mol-(-285.8 kJ/mol)-(-283.0 kJ/mol)=+131.5 kJ/mol.
答案:(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.31 kJ/mol (2)+131.5
12.(2011·合肥模拟)甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)===2CO(g)+4H2(g)ΔH=-71 kJ/mol
②CO(g)+2H2(g)===CH3OH(l)ΔH=-90.5 kJ/mol
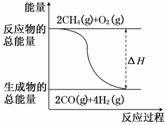 下列描述错误的是( )
下列描述错误的是( )
A.CO(g)+2H2(g)===CH3OH(g)ΔH>-90.5 kJ/mol
B.在甲醇燃料电池中,甲醇所在的电极为正极
C.CH4(g)+1/2O2(g)===CH3OH(l)ΔH=-126 kJ/mol
D.反应①中的能量变化如图所示
解析:液体汽化时吸收能量,则有:③CH3OH(l)===CH3OH(g) ΔH>0,根据盖斯定律,由②、③可知,CO(g)+2H2(g)===CH3OH(g) ΔH>-90.5 kJ/mol,A正确;甲醇燃料电池中,甲醇所在的电极为负极,B错误;根据盖斯定律,将①×+②可得:CH4(g)+O2(g)===CH3(OH)(l) ΔH=-71 kJ/mol×-90.5 kJ/mol=-126 kJ/mol,C正确;反应①ΔH<0,为放热反应,反应物的总能量高于生成物的总能量,D正确.
答案:B
11.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1 mol化学键时放出的能量(kJ/mol) |
436 |
243 |
431 |
则下列热化学方程式不正确的是( )
A.H2(g)+Cl2(g)===HCl(g)
ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.H2(g)+Cl2(g)===HCl(g)
ΔH=+91.5 kJ/mol
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
解析:一个反应的反应热等于反应物的化学键键能之和-生成物的化学键键能之和.C项应为:H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol.
答案:C
10.已知热化学方程式:
①CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ/mol
②H2(g)+O2(g)===H2O(g);ΔH=-241.8 kJ/mol
则下列说法正确的是( )
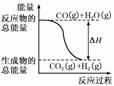 A.H2的燃烧热为241.8
kJ/mol
A.H2的燃烧热为241.8
kJ/mol
B.由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41.2 kJ/mol
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g)+O2(g)===H2O(l)
ΔH>-241.8 kJ/mol
解析:A、D项,根据反应②可知,1 mol H2完全燃烧生成液态水时放出的热量要大于241.8 kJ;B项,①-②得CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41.2 kJ/mol;C项,由B项可知,CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.2 kJ/mol,所以H2(g)转变成H2O(g)的化学反应也可能吸收能量.
答案:B
9.硫有多种单质.S(单斜)和S(正交)是其中的两种同素异形体.已知:
①S(单斜,s)+O2(g)===SO2(g);ΔH1=-297.16 kJ/mol
②S(正交,s)+O2(g)===SO2(g);ΔH2=-296.83 kJ/mol
③S(单斜,s)===S(正交,s) ΔH3
下列说法不正确的是( )
A.ΔH3<0
B.正交硫比单斜硫稳定
C.单斜硫转化为正交硫是吸热反应
D.质量相等时,单斜硫能量比正交硫能量高
解析:根据盖斯定律,ΔH3=ΔH1-ΔH2=-297.16 kJ/mol-(-296.83 kJ/mol)=-0.33 kJ/mol<0;由热化学方程式可知,单斜硫转化为正交硫是放热反应;正交硫比单斜硫稳定;质量相等时,单斜硫比正交硫能量高.
答案:C
8.已知在101 kPa下,1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ.则下列说法中正确的是( )
A.氢气的燃烧热为241.8 kJ/mol
B.1 mol H2O(l)具有的能量大于1 mol H2O(g)具有的能量
C.反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g);ΔH=+483.6
D.2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量
解析:A选项中氢气的燃烧热应指1 mol氢气完全燃烧生成液态水时放出的热量;B选项中前者的能量应小于后者;C选项中ΔH应为负值.
答案:D
7.(2011·西安模拟)氯原子对O3的转化有催化作用:O3+Cl===ClO+O2 ΔH1,ClO+O===Cl+O2 ΔH2,大气臭氧层的转化反应是O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中正确的是( )
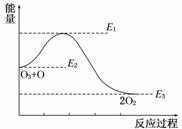
A.反应O3+O===2O2的ΔH=E1-E3
B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应
D.ΔH=ΔH1+ΔH2
解析:O3+O的总能量高于2O2的能量,反应O3+O===2O2为放热反应,ΔH<0,ΔH=E3-E2,A错误,B错误,C错误;根据盖斯定律可得ΔH=ΔH1+ΔH2,D正确.
答案:D
6.(2010·广东高考)在298 K、100 kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
解析:设提供的三个热化学方程式分别为①、②、③,根据盖斯定律,由①+②×2可以得到③,故ΔH1+2ΔH2=ΔH3,A项正确.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com