
题目列表(包括答案和解析)
9.将一块银白色的金属钠放在空气中会发生一系列变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应,生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收了空气中的水蒸气,在表面形成了溶液
C.最后变成的是碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
解析:该过程涉及的反应为:4Na+O2===2Na2O、Na2O+H2O===2NaOH、2NaOH+CO2===Na2CO3+H2O,后两个反应均为非氧化还原反应,D项错误.
答案:D
8.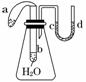 (2011·昆明模拟)如图所示装置,试管b中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口.实验时将气球a中的Na2O2抖落到试管b的水中,下列叙述的现象正确的是( )
(2011·昆明模拟)如图所示装置,试管b中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口.实验时将气球a中的Na2O2抖落到试管b的水中,下列叙述的现象正确的是( )
A.U形管内红水褪色 B.试管内溶液变红
C.气球a被吹大膨胀 D.U形管水位不变
解析:Na2O2抖落到试管b的水中后发生以下反应:2Na2O2+2H2O===4NaOH+O2↑,该反应产生的O2使气球a膨胀,放出的热量使锥形瓶中的气体膨胀,导致U形管c端水位下降,d端水位上升.
答案:C
7.把NaHCO3和NaOH的混合物放在密闭容器中加热,下列关于混合物加热前后消耗盐酸的物质的量的判断正确的是( )
A.加热前消耗得多
B.加热后消耗得多
C.加热前后一样多
D.当NaOH适量时才会一样多
解析:加热前后反应物均与盐酸反应生成NaCl,因加热前后Na+数目不变,由守恒关系知消耗盐酸的物质的量一样多.
答案:C
6.(2010·安徽高考)将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)( )
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
解析:Na2O2、Na2O与水反应的方程式分别为:Na2O2+H2O===2NaOH+O2↑、Na2O+H2O===2NaOH,二者均产生0.2 mol OH-,因溶液体积变化忽略不计,故①=②;Na2CO3和NaCl电离产生的阴离子均为0.1 mol,而CO发生微弱的水解:CO+H2O HCO+OH-,阴离子数目增多,③>④.
HCO+OH-,阴离子数目增多,③>④.
答案:C
5.(2011·镇江模拟)下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液 ③少量电石投入到过量NaHCO3溶液中 ④Na2O2投入到FeCl2溶液中
A.① B.③
C.②③ D.①③④
解析:①金属钠投入到FeCl3溶液中:6Na+6H2O+2FeCl3===2Fe(OH)3↓+6NaCl+3H2↑;②过量NaOH溶液和明矾溶液混合:Al3++4OH-===AlO+2H2O;③少量电石投入到过量NaHCO3溶液中:CaC2+2H2O―→Ca(OH)2+C2H2↑;Ca(OH)2+2HCO===CaCO3↓+CO+2H2O;④Na2O2投入到FeCl2溶液中:2Na2O2+2H2O===4NaOH+O2↑,Fe2++2OH-===Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3.
答案:D
4.下列说法中,正确的是( )
A.Na2O2是碱性氧化物,溶于水生成相应的强碱
B.金属钠应保存在磨口玻璃瓶中
C.金属钠在常温下和氧气反应生成氧化钠
D.固体NaOH暴露在空气中,极易吸收空气中的CO2,其溶液中必然含有CO、HCO、OH-等
解析:Na2O2与水反应属于氧化还原反应生成NaOH和O2,故Na2O2不是碱性氧化物,属于过氧化物.金属钠易被空气中的O2氧化,应保存在煤油中.在NaOH溶液中不可能大量存在HCO,因二者不能大量共存.
答案:C
3.下列反应的离子方程式书写正确的是( )
A.碳酸钠溶液跟盐酸混合:CO+2H+===CO2↑+H2O
B.碳酸氢钠溶液跟石灰水混合:HCO+OH-===CO+H2O
C.碳酸氢钠溶液跟氢氧化钠溶液混合:H++OH-===H2O
D.金属钠投入水中:Na+H2O===Na++OH-+H2↑
解析:B中应该生成碳酸钙沉淀,C中应是碳酸氢根离子和氢氧根离子反应,D中反应前后原子个数不守恒.
答案:A
2.向0.1 mol/L NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )
A.Na+、CO B.Na+、HCO
C.HCO、CO D.Na+、OH-
解析:NaOH与过量的多元弱酸反应生成酸式盐,故选B.
答案:B
1.下列几种物质露置于空气中都会变质,其中一种物质在变质过程中发生反应的类型不同于另外三种物质的是( )
A.钠 B.漂白粉
C.氧化钠 D.过氧化钠
解析:Na、Ca(ClO)2、Na2O2在空气中变质的过程均涉及氧化还原反应,但Na2O变质时发生反应Na2O+H2O===2NaOH,Na2O+CO2===Na2CO3,均不属于氧化还原反应.
答案:C
16.(14分)(1)2010年10月1日搭载“嫦娥二号”卫星的长征三号丙运载火箭在西昌卫星发射中心成功发射.该火箭使用的推进剂是液氢和液氧,这种推进剂的优点是______________________________________
________________________________________________________.
(2)已知:H2(g)+O2(g)===H2O(l);ΔH=-285.8 kJ/mol
H2(g)===H2(l);ΔH=-0.92 kJ/mol
O2(g)===O2(l);ΔH=-68.4 kJ/mol
H2O(l)===H2O(g);ΔH=+44.0 kJ/mol
则液氢与液氧反应生成气态水的热化学方程式为______________________________.
(3)如果此次“嫦娥二号”所携带的燃料为1.08吨,液氢、液氧恰好完全反应生成气态水,总共释放能量________kJ(保留3位有效数字).
解析:(1)H2与O2反应的产物是水,对环境无污染;且相同质量H2与其他燃料相比较,放出的热量多.
(2)1 mol液态氢转化为气态氢需要吸收0.92 kJ热量,mol液态氧转化为气态氧需要吸收68.4 kJ×=34.2 kJ热量.1 mol液态水转化为气态水需要吸收44 kJ热量.因此,1 mol液氢与 mol液氧反应生成1 mol气态水放出的热量为:285.8 kJ-0.92 kJ-34.2 kJ-44 kJ=206.28 kJ.
(3)H2和O2恰好完全反应的质量比为(2×2)∶32=1∶8.
则1.08×106 g燃料中n(H2)==6×104 mol反应释放的能量为6×104 mol×206.68 kJ/mol=1.24×107 kJ.
答案:(1)相同质量时,氢气燃烧放出的热量多,产物为水,无污染
(2)H2(l)+O2(l)===H2O(g);ΔH=-206.68 kJ/mol
(3)1.24×107
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com