
题目列表(包括答案和解析)
3.下列物质中最简式相同,但既不是同系物,也不是同分异构体的是( )
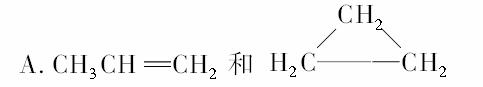 B.乙炔和苯
B.乙炔和苯
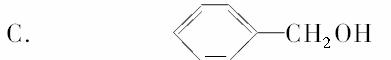
D.乙酸和甲酸甲酯
[解析] A、C、D项互为同分异构体。
[答案] B
2.下列对有机化合物的分类结果正确的是( )
A.乙烯CH2CH2、苯、环己烷都属于脂肪烃
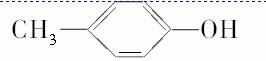
B.苯、环戊烷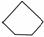 、环己烷同属于芳香烃
、环己烷同属于芳香烃
C.乙烯CH2CH2、乙炔CHCH同属于烯烃
D. 同属于环烷烃
同属于环烷烃
[解析] 本题考查了烃类的分类,属于概念辨析题。明确判断出:烷、烯、炔都属于脂肪链烃,而苯、环己烷、环戊烷都属于环烃,而苯是环烃中的芳香烃。环戊烷、环丁烷及乙基环己烷均是环烃中的环烷烃。
[答案] D
1.
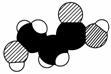
右图是某有机物分子的比例模型,有关该物质的推断不正确的是( )
A.分子中含有羟基
B.分子中含有羧基
C.分子中含有氨基
D.该物质的分子式为C3H6O3
[解析] 据C、H、O、N等原子的价电子排布及有机物成键特点、原子半径的比例,可知黑球为碳、浅色球为氧、白球为氢,此有机物的结构简式为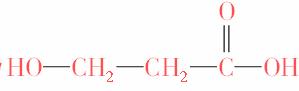 ,C选项不正确。
,C选项不正确。
[答案] C
16.(14分)(2010·浙江高考)汽车安全气囊是行车安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害.为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验.经组成分析,确定该粉末仅含Na、Fe、N、O四种元素.水溶性实验表明,固体粉末部分溶解.经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸.
取13.0 g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72 L.单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质.化合物丙与空气接触可转化为可溶性盐.
请回答下列问题:
(1)甲的化学式为__________,丙的电子式为__________.
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为____________________.
(3)单质乙与红棕色粉末发生反应的化学方程式为________________________,安全气囊中红棕色粉末的作用是________________________.
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是________.
A.KCl B.KNO3
C.Na2S D.CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物)__________________________________________________________________.
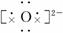 解析:红棕色固体为Fe2O3,则可溶物中含有Na、N元素,再由化合物甲受热分解生成氮气和单质乙,知乙为单质钠,甲中含有钠元素和氮元素,由题给信息计算知甲的化学式为NaN3.钠在高温隔绝空气条件下与Fe2O3发生置换反应,生成铁和Na2O,故丙为Na2O,Na2O与空气中的CO2和H2O反应生成Na2CO3或NaHCO3.若Na2O转化为NaHCO3,则反应的方程式为:Na2O+2CO2+H2O===2NaHCO3.
解析:红棕色固体为Fe2O3,则可溶物中含有Na、N元素,再由化合物甲受热分解生成氮气和单质乙,知乙为单质钠,甲中含有钠元素和氮元素,由题给信息计算知甲的化学式为NaN3.钠在高温隔绝空气条件下与Fe2O3发生置换反应,生成铁和Na2O,故丙为Na2O,Na2O与空气中的CO2和H2O反应生成Na2CO3或NaHCO3.若Na2O转化为NaHCO3,则反应的方程式为:Na2O+2CO2+H2O===2NaHCO3.
答案:(1)NaN3 Na+ Na+
(2)Na2O+2CO2+H2O===2NaHCO3
(3)6Na+Fe2O32Fe+3Na2O 避免分解产生的金属钠可能产生的危害
(4)BD (5)可溶性盐的成分可能是Na2CO3或NaHCO3或Na2CO3与NaHCO3的混合物.准确称取一定量的生成物,加热至恒重后,如试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3或Na2CO3与NaHCO3的混合物.
15.(16分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示.

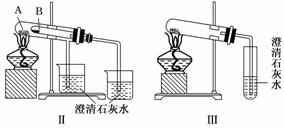
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是
________________________________________________________________________.
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为__________;
与实验Ⅲ相比,实验Ⅱ的优点是(填选项代号)________.
A.Ⅱ比Ⅲ复杂
B.Ⅱ比Ⅲ安全
C.Ⅱ比Ⅲ操作简便
D.Ⅱ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是(填化学式)________.
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应.
①当石灰水过量时,其离子方程式为_________________________________________
____________________________;
②当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为____,请设计实验检验所得溶液中溶质的阴离子________________________________________.
________________________________________________________________________.
解析:(1)图Ⅰ不能达到鉴别目的,因为不论碳酸钠还是碳酸氢钠均可与盐酸反应产生二氧化碳,二氧化碳能使澄清石灰水变浑浊.
(2)图Ⅱ、Ⅲ所涉及的化学方程式为:2NaHCO3△Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O,实验Ⅱ的优点是可同时做对比实验.
(3)试管B装入碳酸氢钠,试管A装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠很不稳定.
(4)①石灰水过量时,碳酸氢根离子全部反应,离子方程式为:Ca2++OH-+HCO===CaCO3↓+H2O;②2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,则其中的溶质是碳酸钠,要检验CO,可以取少量上层清液于洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO.
答案:(1)不论是Na2CO3还是NaHCO3均可与盐酸反应产生CO2,两者的现象相同,故达不到鉴别的目的
(2)2NaHCO3=====,\s\up7(△Na2CO3+H2O+CO2↑,
CO2+Ca(OH)2===CaCO3↓+H2O D
(3)NaHCO3
(4)①Ca2++OH-+HCO===CaCO3↓+H2O
②Na2CO3 取少量上层清液(或过滤后的滤液)于洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO
14.(10分)A、B、C、D是按原子序数由小到大排列的第2、3周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数之比为1∶2.在一定条件下,各物质之间的相互转化关系如图所示(图中部分产物未列出):

请填写下列空白:
(1)A是________,C是________.
(2)H与盐酸反应生成E的化学方程式是_______________________________________.
(3)E与F反应的化学方程式是_____________________________________________
________________________.
解析:单质B是组成空气的成分(O2或N2),而化合物F是由B、C两元素组成的化合物,F的焰色反应为黄色,故C为Na.化合物G是由C(Na)和D组成,且金属(Na)与非金属元素(D)的原子个数比为2∶1,即非金属D在化合物G中显-2价,根据D为第3周期元素可知,D为S,亦即G为Na2S.G(Na2S)+F――→,\s\up7(水I+D(S),该反应为氧化还原反应,化合物F能将S2-氧化成S,故F具有强氧化性,而F的组成元素为钠和氧,所以F为Na2O2.空气的成分之一E能与Na2O2反应放出O2,结合H与盐酸反应可得到E,故E为CO2,A为碳.
答案:(1)碳(或C) 钠(或Na)
(2)Na2CO3+2HCl===2NaCl+H2O+CO2↑
(3)2CO2+2Na2O2===2Na2CO3+O2
13.(12分)分别采取什么方法除去下列物质中的杂质,并写出有关的化学方程式.
(1)NaOH溶液中混有少量Na2CO3._______________________________________;
化学方程式_________________________________________________________.
(2)Na2CO3固体中混有少量NaHCO3固体.________;化学方程式______________.
(3)NaHCO3溶液中混有少量Na2CO3.__________________________________;
化学方程式__________________________________________________________.
答案:(1)加入适量的氢氧化钡溶液
Na2CO3+Ba(OH)2===BaCO3↓+2NaOH
(2)加热 2NaHCO3Na2CO3+CO2↑+H2O
(3)通入过量CO2 Na2CO3+H2O+CO2===2NaHCO3
12.将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1 mol/L盐酸20
mL,此时沉淀量达到最大值,则原合金中钠的质量为( )
A.0.02 g B.0.46 g
C.0.80 g D.0.23 g
解析:由题意沉淀量达到最大值,此时溶液为NaCl,即合金中钠的物质的量与Cl-的物质的量相等,即1 mol/L×0.020 L=0.02 mol,质量为0.02 mol×23 g/mol=0.46 g.
答案:B
11.(2011·朝阳模拟)有关Na2CO3和NaHCO3的叙述中正确的是( )
A.Na2CO3比NaHCO3的热稳定性强
B.Na2CO3和NaHCO3溶液中离子的种类不同
C.Na2CO3和NaHCO3均可与NaOH溶液反应
D.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
解析:Na2CO3受热不分解,而NaHCO3受热易分解,A正确;Na2CO3和NaHCO3溶液中离子的种类相同,B错误;Na2CO3与NaOH溶液不反应,C错误;相同质量的Na2CO3和NaHCO3与足量盐酸作用时,NaHCO3产生的气体质量大,D错误.
答案:A
10.(2011·汕头模拟)将4.34 g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为( )
A.4∶3∶2 B.1∶2∶1
C.1∶1∶2 D.1∶1∶1
解析:根据方程式2Na+2H2O===2NaOH+H2↑、2Na2O2+2H2O===4NaOH+O2↑、O2+2H2放电2H2O计算可知,Na与2Na2O2物质的量之比为2∶1,只有A符合.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com