
题目列表(包括答案和解析)
7.(2011重庆) 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
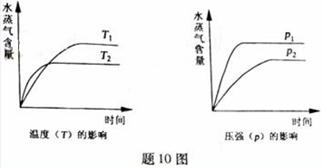
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g); △H<0
CO(NH2)2(s)+H2O(g); △H<0
B.CO2(g)+H2(g) CO(g)+H2O(g); △H>0
CO(g)+H2O(g); △H>0
C.CH3CH2OH (g) CH2=CH2(g)+H2O(g); △H>0
CH2=CH2(g)+H2O(g); △H>0
D.2C6H5CH2CH3(g)+O2(g) 2
C6H5CH=CH2(g)+2H2O(g); △H<0
2
C6H5CH=CH2(g)+2H2O(g); △H<0
解析:本题考察外界条件对化学平衡的影响及有关图像的分析和识别。温度越高,反应越快,到达平衡的时间就越少,因此T2>T1;同理压强越大,反应越快,到达平衡的时间就越少,因此P1>P2;反应A是一个体积减小的、放热的可逆反应,因此升高温度平衡向逆反应方向移动,降低水蒸气的含量;而增大压强平衡向正反应方向移动,增大水蒸气的含量,所以A正确;反应B是一个体积不变的、吸热的可逆反应,压强对水蒸气的含量不影响;升高温度平衡向正反应方向移动,增大水蒸气的含量,因此均不符合;反应C是一个体积增大的、吸热的可逆反应,同样分析也均不符合;反应D是一个体积增大的、放热的可逆反应,压强不符合。
答案:A
6.(2011天津)向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a-b段小于b-c段
解析:这是一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响。由图可以看出随着反应的进行正反应速率逐渐增大,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快,所以选项C不正确;但当到达c点后正反应反而降低,这么说此时反应物浓度的影响是主要的,因为反应物浓度越来越小了。但反应不一定达到平衡状态,所以选项A、B均不正确;正反应速率越快,消耗的二氧化硫就越多,因此选项D是正确的。
答案:D
5.(2011福建高考12)25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。

下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
解析:由于铅是固体状态,往平衡体系中加入金属铅后,平衡不移动,c(Pb2+)不变;往平衡体系中加入少量Sn(NO3)2固体后,平衡向左移动,c(Pb2+)变大;升高温度,平衡体系中c(Pb2+)增大,平衡向左移动,说明该反应是放热反应,即△H﹤0;25℃时,该反应的平衡常数K=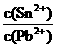 =0.22/0.10=2.2,故D项正确。
=0.22/0.10=2.2,故D项正确。
此题也是新情景,考查平衡移动原理以及平衡常数计算,题目不偏不怪,只要基础扎实的同学都能顺利作答。
答案:D
4.(2011北京高考12)已知反应:2CH3COCH3(l)  CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是
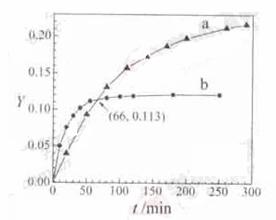
A.b代表0℃下CH3COCH3的Y-t曲线
B.反应进行到20min末,H3COCH3的
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
解析:温度高反应速率就快,到达平衡的时间就短,由图像可与看出曲线b首先到达平衡,所以曲线b表示的是20℃时的Y-t曲线,A不正确;根据图像温度越高CH3COCH3转化的越少,说明升高温度平衡向逆反应方向进行,即正方应是放热反应,C不正确;当反应进行到反应进行到20min时,从图像中可以看出b曲线对应的转化分数高于a曲线对应的转化分数,这说明b曲线即20℃时对应的反应速率快,所以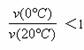 ,B不正确;根据图像可以看出当反应进行到66min时a、b曲线对应的转化分数均相同,都是0.113,这说明此时生成的CH3COCH2COH(CH3)2一样多,所以从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
,B不正确;根据图像可以看出当反应进行到66min时a、b曲线对应的转化分数均相同,都是0.113,这说明此时生成的CH3COCH2COH(CH3)2一样多,所以从Y=0到Y=0.113,CH3COCH2COH(CH3)2的 ,即选项D正确。
,即选项D正确。
答案:D
3.(2011安徽高考9)电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2
PbCrO4(s)+2H+(aq) ΔH< 0
2
PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
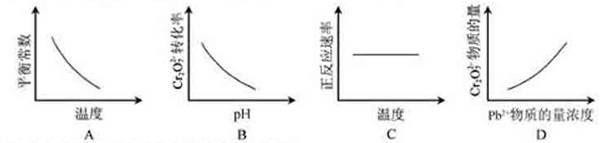
解析:由题意知该反应是一个放热的可逆反应,升高温度平衡向吸热的逆反应方向移动,依据平衡常数的表达式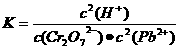 可知K应该减小,A正确;pH增大溶液碱性增强,会中和溶液中H+,降低生成物浓度平衡向正方应方向移动,Cr2O72-的转化率会增大,B不正确;温度升高,正、逆反应速率都增大,C错误;增大反应物Pb2+的浓度,平衡向正方应方向移动,Cr2O72-的物质的量会减小,D不正确。
可知K应该减小,A正确;pH增大溶液碱性增强,会中和溶液中H+,降低生成物浓度平衡向正方应方向移动,Cr2O72-的转化率会增大,B不正确;温度升高,正、逆反应速率都增大,C错误;增大反应物Pb2+的浓度,平衡向正方应方向移动,Cr2O72-的物质的量会减小,D不正确。
答案:A
2.(2011江苏高考15)700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
|
反应时间/min |
n(CO)/mol |
H2O/
mol |
|
0 |
1.20 |
0.60 |
|
t1 |
0.80 |
|
|
t2 |
|
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
[分析]本题属于基本理论中化学平衡问题,主要考查学生对速率概念与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。高三复习要让学生深刻理解一些基本概念的内涵和外延。
A.反应在t1min内的平均速率应该是t1min内H2浓度变化与t1的比值,而不是H2物质的量的变化与t1的比值。
B.因为反应前后物质的量保持不变,保持其他条件不变,平衡常数不会改变,起始时向容器中充入0.60molCO和1.20 molH2O,似乎与起始时向容器中充入0.60molH2O和1.20 molCO效果是一致的,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大。
D.原平衡常数可通过三段式列式计算(注意浓度代入)结果为1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应。
答案:BC
1.(2011江苏高考12)下列说法正确的是
A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0 △S>0
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D.对于反应2H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
解析:本题是化学反应与热效应、电化学等的简单综合题,着力考查学生对熵变、焓变,水解反应、原电池电解池、化学反应速率的影响因素等方面的能力。
A.分解反应是吸热反应,熵变、焓变都大于零,内容来源于选修四化学方向的判断。
B.水解反应是吸热反应,温度越高越水解,有利于向水解方向移动。
C.铅蓄电池放电时的负极失电子,生氧化反应。
D.升高温度和加入正催化剂一般都能加快反应速率。
答案:AD
16.(12分)碱金属的氧化物有多种:普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2.其中KO2与CO2反应生成K2CO3放出O2.
(1)写出KO2与CO2反应的化学方程式_________________________________________.
(2)相同物质的量的Na2O2与KO2分别与足量CO2反应,哪一个放出的O2多?其物质的量之比为________.
解析:(1)根据信息:KO2与CO2反应生成K2CO3和O2.
反应方程式为:4KO2+2CO2===2K2CO3+3O2
(2)Na2O2与CO2反应:2Na2O2+2CO2===2Na2CO3+O2
因此相同物质的量的Na2O2与KO2,KO2与CO2反应放出的O2多.
其产生O2的物质的量之比为∶=2∶3.
答案:(1)4KO2+2CO2===2K2CO3+3O2
(2)KO2放出的O2多;2∶3
15.(14分)金属钠或金属钾在加热条件下,能与干燥的氢气反应,生成白色固体NaH、KH.这些碱金属的氢化物不同于非金属气态氢化物,如NaH、KH与水反应得到氢气和NaOH或KOH.试回答:
(1)写出金属钠在氢气流中加热的化学方程式,并注明电子转移方向和总数:________.
(2)NaH中的化合态氢应具有氧化性,还是还原性?简答理由:___________________
________________________________________________________________________.
(3)NaH与水反应时的氧化产物与还原产物质量比是__________.
(4)有相同质量的NaH与水、Zn与盐酸充分反应的供氢量的关系是________________
________________________________________________________________________.
(5)Ti是一种非常优秀的金属,人们常用NaH与TiCl4在高温下反应制Ti,写出其化学方程式________________________________________________________________________
________________________________________________________________________.
解析:金属钠与非金属反应,都是失去电子.生成的NaH中H元素显-1价,在反应中易被氧化.与水反应的化学方程式:NaH+H2O===NaOH+H2↑,电子转移情况是:

 其余部分不难通过计算与分析完成.
其余部分不难通过计算与分析完成.
答案:(1)
(2)NaH中化合态氢具有强还原性,NaH中H为H-,是带一个负电荷的阴离子,是最低价,只能失电子体现出强还原性
(3)1∶1
(4)NaH与水反应的供氢量是同质量锌与盐酸反应的供氢量的2.7倍
(5)TiCl4+2NaH△Ti+2NaCl+2HCl↑
14.(18分)有A、B、C三种粉末,透过蓝色钴玻璃观察其焰色均为紫色,它们具有下列性质:
①均易溶于水,且A与B反应生成C;
②加热B的粉末时,生成无色无刺激性气味的气体D,D能使澄清的石灰水变浑浊,浑浊物为E;
③加热A、C时均不反应;
④向C溶液中通入D可以得到B;
⑤A溶液和D反应,A过量时生成C,A不足时生成B.
请回答下列问题:
(1)写出下列物质的化学式:A____________,B____________,C____________,D____________,E____________.
(2)用离子方程式表示下列反应:
A+B:____________________________________________________________;
D―→E:_____________________________________________________________;
C+D:____________________________________________________________;
A+D―→B:___________________________________________________________;
A+D―→C:__________________________________________________________.
解析:由三种物质的焰色反应知三种物质均含钾元素;由B受热分解能够产生使澄清的石灰水变浑浊的无色无刺激性气味的气体可以推知,B是KHCO3,D是CO2,E是CaCO3;由A溶液和D反应,A过量时生成C,A不足时生成B可以推知,A是KOH,C是K2CO3,进一步可以确定B是KHCO3;通过④可以进一步验证得出的结论.
答案:(1)KOH KHCO3 K2CO3 CO2 CaCO3
(2)HCO+OH-===CO+H2O
CO2+Ca2++2OH-===CaCO3↓+H2O
CO+CO2+H2O===2HCO
CO2+OH-===HCO
CO2+2OH-===CO+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com