
题目列表(包括答案和解析)
1.下列各变化中,在木炭燃烧时不可能发生的反应是( )

[解析] CO2不能分解,因此,D项错误。
[答案] D
16.(14分)(2010年榆林或2010年威海质检)t ℃时,向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体,保持温度不变,使之发生反应,各物质浓度随时间的变化如下图中甲图所示[t0-t1阶段c(B)未画出],乙图为t2时刻后改变容器中条件,反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;t5-t6阶段容器内B的物质的量共增加0.01 mol,而此过程中容器与外界的热交换总量为a kJ。
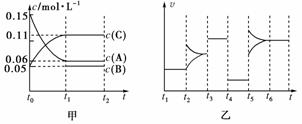
(1)t5-t6阶段改变的条件为__________;
(2)该反应建立第一次平衡时的化学平衡常数为__________;
(3)在t1-t6的平衡阶段中,平衡常数的有关变化为________(填序号);
a.t3-t4增大、t5-t6增大
b.t3-t4增大、t5-t6减小
c.t3-t5阶段不变、t5-t6增大
d.t3-t5阶段不变、t5-t6减小
(4)如果t5-t6阶段同时采取t3-t4阶段的措施,此过程中容器与外界的热交换总量将________(填“大于”、“小于”或“等于”)a kJ,理由是____________________________________。
[解析] (1)t2-t3阶段:根据图象可知,t2时刻向体系中加入了反应物或者生成物;t3-t4阶段:加入了催化剂;t4-t5阶段和t5-t6阶段:这两个阶段应为改变温度或压强,当改变(升高或降低)温度时,必然引起平衡的正向或逆向移动,而改变压强时,如果方程式两边气体物质的化学计量数之和相等,平衡就不会移动,所以t4-t5阶段为改变压强,t5-t6阶段为改变温度,由于t5-t6阶段正、逆反应速率均比原来大,说明是升高温度,而t4-t5阶段正、逆反应速率均比原来小,说明是减小压强。
(2)向该密闭容器中加入0.3 mol A、0.1 mol C后,其浓度分别为0.15 mol·L-1和0.05 mol·L-1,说明容器的体积为2 L,通过前面的分析,我们已经知道该反应前后气体物质的量不变,甲图中A(反应物)、C(生成物)两种物质的浓度变化数值之比为=,所以B应为生成物,且化学计量数为1,即反应的方程式为3A(g)2C(g)+B(g),K==2.80。因为化学平衡常数只与温度有关,所以t1-t5阶段平衡常数不变,而t5-t6阶段是升高温度,平衡常数增大。(5)若在t5-t6阶段同时使用催化剂,只能同等程度加快正逆反应速率而不改变反应热,所以此过程中容器与外界的热交换总量不变。
[答案] (1)升高温度 (2)2.80 (3)c (4)等于 使用催化剂,可以同等程度加快正逆反应的速率,但不改变反应热(或不改变平衡状态等)
15.(17分)(2009年广东高考)甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l) ΔH>0某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
|
组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
|
物质的量/mol |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图:
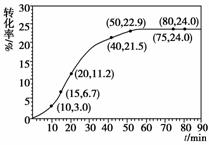
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
|
反应时间 |
|
|
|
|
|
|
|
|
范围/min |
0-5 |
10-15 |
20-25 |
30-35 |
40-45 |
50-55 |
75-80 |
|
平均反应速率/ |
|
|
|
|
|
|
|
|
(10-3 mol·min-1) |
1.9 |
7.4 |
7.8 |
4.4 |
1.6 |
0.8 |
0.0 |
请计算15-20 min范围内甲酸甲酯的减少量为______mol,甲酸甲酯的平均反应速率为__________mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应速率在不同阶段的变化规律及其原因:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)上述反应的平衡常数表达式为:
K=,则该反应在温度T1下的K值为______。
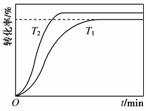
(4)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
[解析] (1)由图中数据可以看出15-20 min内甲酸甲酯转化率提高了4.5%,利用转化率和速率的计算式计算。
(2)表格中平均反应速率的数据显示反应速率先增大后减小,因该反应是吸热反应排除温度升高的影响,则只能是反应体系中的某物质对该反应起到催化剂作用,而起始反应物中HCOOH的量很小,只能是其具有催化作用造成的。
(3)同一混合体系中各物质的浓度之比与物质的量之比相等,故可将平衡时刻各物质的物质的量代入平衡常数计算公式求算。
(4)注意该反应是吸热反应,T2>T1,温度升高,既能加快反应速率,又能缩短达到平衡的时间,提高转化率。
[答案] (1)0.045 9.0×10-3
(2)该反应中甲酸具有催化作用。①反应初期:虽然甲酸甲酯量较大,但甲酸量很小,催化效果不明显,反应速率较慢;②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大;③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使正反应速率逐渐减小,直至达到平衡状态 (3)0.14
(4)
14.(15分)在体积为1 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),反应焓变为ΔH,其化学平衡常数K和温度T的关系如下表:
|
T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的ΔH______0。(填“>”或“<”)
(2)能判断该反应是否达到化学平衡状态的依据是______。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)若上述反应以CO和水蒸气为起始反应物,在T ℃时CO和H2O(g)的浓度变化如图所示,则0-4 min的平均反应速率v(CO2)=______mol/(L·min),T=______℃。
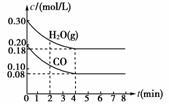
[解析] (1)由表格中温度与化学平衡常数的关系可知,温度越高,化学平衡常数(K)越大,即升高温度,平衡向正反应方向移动,故正反应为吸热反应,ΔH>0。(2)反应前后混合气体的总物质的量不变,所以压强在反应过程中始终不变。
(3)v(CO2)==0.03 mol/(L·min)。4 min时,c(H2O)=0.18 mol/L,c(CO)=0.08 mol/L,c(H2)=0.12 mol/L,c(CO2)=0.12 mol/L,计算化学平衡常数K=1,查表可知 K=1对应的温度为850 ℃。
[答案] (1)> (2)BC (3)0.03 850
13.(6分)在密闭容器中进行如下反应:mA(g)+nB(g)pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了a mol·L-1,又知平均反应速率:v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:
m=______,n=______,p=______。
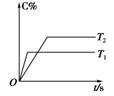
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。由此可知,该反应为 (填“吸热”或“放热”)反应。
[解析] (1)根据速率之比等于化学计量数之比,则m∶n∶p=3∶1∶2,故m=3,n=1,p=2。
(2)由图象可知T1>T2,升温C%减小,平衡逆移,说明正向放热。
[答案] (1)3 1 2 (2)放热
12.(2010年张家港质检)T ℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )

A.该反应的热化学方程式为2A(g)+7B(g)4C(g) ΔH<0
B.在(t1+10)min 时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T ℃时,在相同容器中,若由0.3 mol·L-1A、0.1 mol·L-1B和0.4 mol·L-1C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
[解析] 由图(Ⅰ)知达到平衡时,A减少了0.2 mol/L,B减少了0.6 mol·L-1,C增加了0.4 mol/L,故反应方程式为:A(g)+3B(g)2C(g);由方程式知增大压强,平衡向正反应方向移动;由图(Ⅱ)知T1>T2,当温度高(T1)时,平衡状态B%大,故该反应的正反应为放热反应,ΔH<0,升高温度时,平衡向逆反应方向移动,A的转化率减小;对照图(Ⅰ)可知C项中各物质的浓度即平衡浓度,即此状态时反应已经处于平衡状态。
[答案] C
11.等容积的四个密闭容器中,进行同样的可逆反应:
2A(g)+B(g)3C(g)+2D(g),起始时四个容器中A、B的物质的量分别如下表所示(mol),在相同条件下建立平衡,A或B的转化率大小关系为(多选)( )
|
|
甲 |
乙 |
丙 |
丁 |
|
A |
2 |
1 |
2 |
1 |
|
B |
1 |
1 |
2 |
2 |
A.A的转化率为:甲<丙<乙<丁
B.A的转化率为:甲<乙<丙<丁
C.B的转化率为:甲>乙>丙>丁
D.B的转化率为:甲>丙>乙>丁
[解析] 丙相当于乙缩小体积,增大压强,平衡向逆反应方向移动。丙中A、B转化率均小于乙;丙相当于在甲中再加入1 mol B,平衡右移,丙中A转化率大于甲中A转化率;丁相当于乙中再加入1 mol B,平衡右移,丁中A转化率大于乙中A转化率。故A的转化率大小关系为甲<丙<乙<丁,同理可得B的转化率的关系。
[答案] AD
10.一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的正反应为吸热反应
[解析] 2X(g)+Y(g)Z(g)
起始物质 1 1 0
的量(mol)
转移的物 0.6 0.3 0.3
质的量(mol)
平衡物质 0.4 0.7 0.3
的量(mol)
v(X)==0.001 mol·L-1·s-1,A项正确;将容积变为20 L,平衡朝逆反应方向移动,Z的平衡浓度小于原来的,B项不正确;若增大压强,平衡朝正反应方向移动,物质Y的转化率增大,C项错误;若升高温度,X的体积分数增大,平衡朝逆反应方向移动,则该反应的正反应为放热反应,D项错误。
[答案] A
9.(2009年宁夏高考)在一定温度下,反应H2(g)+X2(g)HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5% B.17%
C.25% D.33%
[解析] 由题中反应和数据可知:HX(g)H2(g)+X2(g)的平衡常数K=0.1。设在该温度下HX(g)的分解反应达平衡后其减小的浓度为x mol/L,则平衡时HX、H2、X2的浓度分别为(1.0-x)mol/L,0.5x mol/L,0.5x mol/L,代入K的表达式有:(0.5 x)1/2·(0.5x)1/2/(1.0-x)=0.1,解得x=0.167,故可知HX的转化率为×100%=16.7%。
[答案] B
8.在某恒容的密闭容器中,可逆反应A(g)+B(g)xC(g)有如下图所示的关系曲线,下列说法正确的是( )
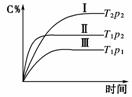
A.温度:T1>T2 B.压强:p1>p2
C.正反应是吸热反应 D.x的值是2
[解析] 比较曲线Ⅰ和Ⅱ,压强均为p2,T1时可逆反应先达到平衡,故T1>T2;温度由T1降至T2时C%增大,说明降温使平衡向正反应方向移动,因此该反应的正向反应为放热反应。比较曲线Ⅱ和Ⅲ,温度均为T1,压强为p2时反应先达到平衡,说明p2>p1。压强从p2减至p1,C%减小,说明减压后平衡向逆反应方向移动,因此正反应为体积减小反应,x=1。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com