
题目列表(包括答案和解析)
11.某混合气体中可能有H2、CO、CO2、HCl、NH3及水蒸气中的两种或多种,当混合气体依次通过①适量澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓硫酸(无现象);④灼热的氧化铜(变红);⑤无水硫酸铜(变蓝);则对该混合气体的成分判断正确的是( )
A.一定没有CO2,肯定有CO和H2
B.一定有CO、CO2和水蒸气
C.一定有H2、HCl和CO2
D.有CO2、NH3和水蒸气
[解析] 澄清石灰水没有变浑浊,而氢氧化钡溶液变浑浊了,说明气体有两种可能:①原气体中有大量的CO2,它与Ca(OH)2反应生成Ca(HCO3)2溶液后还有剩余(但此题不可能,因反应过程中会有浑浊现象),通过Ba(OH)2就生成了BaCO3而变浑浊;②原气体有CO2和HCl,通过Ca(OH)2时HCl被吸收掉从而生成CaCl2,CO2不与CaCl2反应,所以无现象。再通过Ba(OH)2时,CO2与Ba(OH)2反应生成了BaCO3而变浑浊,从题干后面所给信息不难判断出一定有H2。
[答案] C
10.将CO2通入100 mL某浓度的石灰水中,所得沉淀质量与通入CO2体积(标准状况)的关系如右
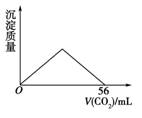
图所示,则石灰水浓度为( )
A.0.03 mol·L-1
B.0.015 mol·L-1
C.0.025 mol·L-1
D.0.012 5 mol·L-1
[解析] 当生成的CaCO3沉淀恰好溶解时,消耗CO256 mL,此时恰好发生反应:
Ca(OH)2+2CO2===Ca(HCO3)2
n[Ca(OH)2]=×=0.001 25 mol,
c[Ca(OH)2]==0.012 5 mol·L-1。
[答案] D
9.(2010年浙江五校联考)用20 mL 2 mol/L的H2SO4溶液与20 mL 3 mol/L的Na2CO3溶液反应来制取CO2,欲制得最多的CO2,则下列操作正确的是( )
A.把20 mL Na2CO3溶液缓缓滴加到20 mL H2SO4溶液中
B.把20 mL H2SO4溶液缓缓滴加到20 mL Na2CO3溶液中
C.把两种溶液快速混合并不断搅拌
D.把两种溶液缓慢混合并不断搅拌
[解析] 由于CO32-转化为CO2的过程为:CO32-HCO3-CO2,故当试剂的量一定时,将Na2CO3溶液滴入H2SO4溶液中时,CO32-可以立即转化为CO2气体放出,此种情况下产生的气体最多。
[答案] A
8.向0.1 mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )
A.Na+、CO32- B.Na+、HCO3-
C.HCO3-、CO32- D.Na+、OH-
[解析] NaOH溶液中通入少量CO2时生成Na2CO3,而通入过量CO2时则生成NaHCO3。
2NaOH+CO2(少量)===Na2CO3+H2O
NaOH+CO2(过量)===NaHCO3。
[答案] B
7.可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是( )
A.加热时有无气体放出
B.滴加盐酸时有无气泡放出
C.溶于水后,滴加稀的氯化镁溶液有无白色沉淀生成
D.溶于水后,滴加澄清石灰水,有无白色沉淀生成
[解析] A项,加热时,碳酸氢钠易分解:2NaHCO3Na2CO3+CO2↑+H2O,碳酸钠不分解,对混合物进行加热,不正确。B项,碳酸钠、碳酸氢钠都能与盐酸反应,反应都生成CO2,现象相同,B项错。D项,碳酸钠、碳酸氢钠都能与澄清石灰水反应,生成白色沉淀,反应现象相同,D项错误。只有C项,碳酸钠与氯化镁反应时,生成白色沉淀,碳酸氢钠与氯化镁不反应,反应现象不同。
[答案] C
6.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
[解析] Ba(OH)2+Na2SO4===BaSO4↓+2NaOH,虽除去了Na2SO4但又增加了新的杂质NaOH。
[答案] D
5.实验室用石灰石和盐酸制取CO2时,最佳的除杂试剂和方法是( )
A.水、浓H2SO4洗气
B.饱和Na2CO3溶液、浓H2SO4洗气
C.饱和NaHCO3溶液、浓H2SO4洗气
D.NaOH溶液、浓H2SO4洗气
[解析] 实验室用石灰石和盐酸制取的CO2中含有HCl和水蒸气,一般用饱和NaHCO3溶液吸收HCl,CO2溶解度却很小,再用浓硫酸吸收水蒸气。
[答案] C
4.下列有关CO2的实验中,只能证明CO2的物理性质的实验是( )
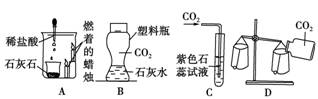
[解析] A选项可以证明CO2的密度比空气大且不能支持蜡烛燃烧,B选项可以证明CO2能与石灰水反应,C选项可以证明CO2溶于水显酸性,D选项只能证明CO2密度比空气密度大。
[答案] D
3.石灰在工农业生产和建筑业有着重要用途。用于生产石灰的主要原料是石灰石(用①表示),在石灰窑中加热焙烧石灰石得到生石灰(用②表示),并放出气体(用③表示)。生石灰在建筑业上主要用做黏合剂,一般先使它“熟化”变成熟石灰(用④表示),熟石灰与砂子混合成灰泥用于砌筑砖墙。经过一段时间后石灰泥中的熟石灰变成另一种固体物质(用⑤表示)。用下列化学式表示这五种物质都正确的是( )
A.①Ca(OH)2 ②CaO ③SO3 ④CaSO4 ⑤CaSO4
B.①CaO ②Ca(OH)2 ③CO ④CaCO3 ⑤CaSiO3
C.①CaCO3 ②CaO ③CO2 ④Ca(OH)2 ⑤CaCO3
D.①CaCO3 ②CaO ③SO2 ④CaSiO3 ⑤Ca(OH)2
[解析] 石灰石主要成分是CaCO3,其分解后生成CaO(生石灰)和CO2气体。CaO与水反应生成Ca(OH)2(熟石灰),经过一段时间吸收CO2又重新生成CaCO3。
[答案] C
2.当下列物质分别滴加醋酸时,会产生相同气体的是( )
①大理石 ②钟乳石 ③贝壳 ④水垢 ⑤白云石
A.只有①②③ B.只有②④⑤
C.只有①③④⑤ D.①②③④⑤
[解析] 上述五种物质的成分均为碳酸盐(都含有CaCO3),分别与醋酸反应时,都会放出CO2气体。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com