
题目列表(包括答案和解析)
5.对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.SO42-
C.H2SO3 D.NH4+
[解析] 实验①说明溶液中有H2SO3,实验②说明溶液中存在NH4+,实验③说明溶液中存在Br-,但不能确定溶液中是否含SO42-,因为当加入氯水时发生反应Cl2+H2SO3+H2O===2HCl+H2SO4,因而无法确定是原溶液中存在SO42-,还是发生上述反应时生成的SO42-,故B项符合题意。
[答案] B
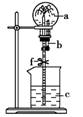
4.在如右图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状态喷出,最终几乎充满烧瓶。则a和b分别是表中的( )
|
|
a(干燥气体) |
b(液体) |
|
A |
NO2 |
H2O |
|
B |
NO |
4 mol·L-1 NaOH溶液 |
|
C |
Cl2 |
饱和NaCl溶液 |
|
D |
NH3 |
1 mol·L-1盐酸 |
[解析] A项能形成喷泉,但最终溶液充满烧瓶的,不符合题意;B、C项不能形成喷泉;D项能形成喷泉,且溶液最终充满烧瓶。
[答案] D
3.如下图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为( )
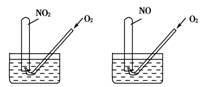
A.1∶1 B.5∶7
C.7∶5 D.4∶3
[解析] NO2、NO装满试管,则体积相同,依据阿伏加德罗定律,n(NO2)=n(NO),根据原子守恒所得硝酸的物质的量相同,溶液的体积相同,所以两个试管中溶液物质的量浓度之比为1∶1。
[答案] A
2.如右图所示,
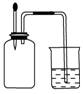
集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④
C.③④ D.②③
[解析] 烧杯里的水进入广口瓶,说明广口瓶里的气体溶于水或与水反应,导致气体压强减小。反应条件为光照(置于光亮处),暗示反应有两种情况:一是反应物本身易溶于水或与水反应,但不生成气体或生成气体分子数减少;二是反应物在光照条件下生成产物易溶于水或生成气体分子数减少。①CO和O2在光照条件下不反应,且均难溶于水,不符合题意;②Cl2和CH4在光照条件下发生取代反应,生成物CH2Cl2、CHCl3、CCl4均为液态,HCl极易溶于水,只有CH3Cl为气态,气体分子数减少,符合题意;③NO2和O2可与水反应:4NO2+O2+2H2O===4HNO3,气体分子数减少,符合题意;④N2和H2在光照条件下不反应,且均难溶于水,不符合题意。
[答案] D
1.“保护环境,就是保护人类自己。”下列环境问题与产生的主要原因不相符的是( )
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NO2等引起的
③“酸雨”主要是由空气中CO2浓度增大引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“厄尔尼诺”现象由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的
⑦“赤潮”主要是由水体中P、N等元素过量引起的
A.只有①② B.只有②③⑤
C.全部 D.只有③
[解析] “保护环境,就是保护人类自己”,环境问题已越来越引起社会的关注,了解一些环境问题产生的主要原因,才能提出合理的治理方案。“臭氧空洞”主要是氟氯代烃引起,而NOx对“臭氧空洞”的形成也有一定作用;光化学烟雾主要是NOx引起的;“酸雨”的形成主要是SO2及NOx引起,故③不正确;“白色污染”是指聚乙烯塑料引起的污染;空气中CO2浓度增大,引起“温室效应”,“厄尔尼诺”也由此而起,“赤潮”、“水华”则是水体中由N、P等营养元素的过量引起的,综上所述,正确答案为D。
[答案] D
16.课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
→→→
下面是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置,如下图所示。
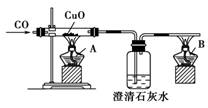
(1)点燃酒精灯A、B的先后顺序为:先______后______。
(2)硬质玻璃管中发生反应的化学方程式为________________________________________________________________________
____________________________________。
(3)洗气瓶中的实验现象为________________________________________________________________________。
(4)酒精灯B的作用为________________________________________________________________________。
(5)乙同学提出甲同学设计的装置太复杂,可将酒精灯合二为一,去掉B,而将尾气导气管出口旋转到A的火焰上即可。乙同学的设计是否合理?简述理由(从A、B使用的一致性的角度考虑)________________________________________________________________________。
(6)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应。试对此作出评价,你认为丙的设计________(填“必要”或“不必要”),理由是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[解析] 由题意知硬质玻璃管中发生反应的化学方程式为CuO+COCu+CO2,显然A处酒精灯提供热源,B处的酒精灯用来点燃未反应的CO,防止其污染环境。若先点燃A处的酒精灯,则CO会与装置内的空气作用发生爆炸。只有在排净装置内的空气后方可点燃A。所以应先点燃B再点燃A且不能将它们合二为一。
[答案] (1)B A (2)CuO+COCu+CO2 (3)澄清石灰水变浑浊 (4)点燃尾气中的CO,防止CO污染环境
(5)不合理,因为CO点燃在先,CuO加热在后,不能同时进行 (6)不必要 加热CuO前必须先通CO,此时即可观察CO是否能使澄清石灰水变浑浊
15.化学活动课上,三组学生用甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查过)。
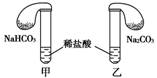
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是:________________________________________________________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
|
|
试剂用量 |
实验现象 (气球体积变化) |
分析原因 |
|
第①组 |
0.42
g NaHCO3 0.53 g Na2CO3 3 mL 4 mol/L盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V甲(CO2)= V乙(CO2) |
|
第②组 |
0.3
g NaHCO3 0.3 g Na2CO3 3 mL 4 mol/L盐酸 |
甲中气球比乙中气球的体积大 |
|
|
第③组 |
0.6
g NaHCO3 0.6 g Na2CO3 缓慢加入 3 mL 2 mol/L盐酸 |
甲中气球比乙中气球的体积大 |
|
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示)________________ |
[解析] (1)甲装置中反应的离子方程式为HCO3-+H+===CO2↑+H2O,乙装置中反应的离子方程式为CO32-+2H+===CO2↑+H2O,因此甲中反应快,气球体积先变大。
(2)与第①组相比较,②组中的NaHCO3和Na2CO3质量相对减小,而盐酸物质的量不变,因此②组中甲、乙装置中的盐酸均过量,NaHCO3和Na2CO3均完全反应产生CO2;由于Na2CO3和NaHCO3等质量且NaHCO3的相对分子质量小,因此n(NaHCO3)>n(Na2CO3),V甲(CO2)>V乙(CO2)。
与第②组相比较,③组中NaHCO3和Na2CO3的质量变为原来的2倍,而盐酸的物质的量减半,因此③组中甲、乙装置中的盐酸均不足量,甲中反应的离子方程式为HCO3-+H+===CO2↑+H2O,乙中反应的离子方程式为CO32-+H+===HCO3- HCO3-+H+===H2O+CO2↑,所以甲、乙装置中消耗样品的物质的量关系为n(NaHCO3)>n(Na2CO3),产生CO2的体积关系为V甲(CO2)>V乙(CO2)。
因为装置乙中存在反应:CO2+CO32-+H2O===2HCO3-,使最初产生的CO2被CO32-吸收,因此乙中的气球先变大后缩小。
[答案] (1)甲 HCO3-+H+===CO2↑+H2O
(2)②甲、乙盐酸均过量,n(NaHCO3)>n(Na2CO3),V甲(CO2)>V乙(CO2)
③甲、乙盐酸均不足量,消耗的n(NaHCO3)>n(Na2CO3),
V甲(CO2)>V乙(CO2) CO2+H2O+CO32-===2HCO3-
14.A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
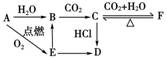
(1)写出A、B、C、D、E、F的化学式:
A.________,B.________,C.________,D.________,E.________,F.________。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
B→C:________________________________________________________________________,
E→B:________________________________________________________________________,
C→F:________________________________________________________________________,
F→C:________________________________________________________________________。
[解析] 据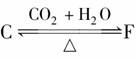 的转化关系,可知C为碳酸盐,F为酸式碳酸盐,再结合E是淡黄色粉末,应为Na2O2,则A、B、C、D、F分别为Na、NaOH、Na2CO3、NaCl、NaHCO3。
的转化关系,可知C为碳酸盐,F为酸式碳酸盐,再结合E是淡黄色粉末,应为Na2O2,则A、B、C、D、F分别为Na、NaOH、Na2CO3、NaCl、NaHCO3。
[答案] (1)Na NaOH Na2CO3 NaCl Na2O2 NaHCO3
(2)B→C:2OH-+CO2===CO32-+H2O
E→B:2Na2O2+2H2O===4Na++4OH-+O2↑
C→F:CO32-+H2O+CO2===2HCO3-
F→C:2NaHCO3Na2CO3+H2O+CO2↑
13.实验室
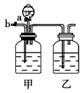
可用右图所示装置将CO2和CO进行分离和干燥,已知a、b均为活塞,试回答下列各题。
(1)甲瓶中装的是 ,乙瓶中装的是 ,分液漏斗中盛放的是 。
(2)当CO2和CO的混合气体通过该装置时,先分离得到的是 ,活塞操作为 ;然后得到的是 ,活塞操作为 。
[答案] (1)NaOH 浓H2SO4 稀HCl
(2)CO 关a开b CO2 开a关b
12.某无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种混合而成。该溶液加入NaOH溶液出现白色沉淀;加入稀H2SO4也出现白色沉淀,并放出气体。据此分析,下述组合判断正确的是( )
①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3 ④肯定有NaHCO3或Na2CO3 ⑤肯定没有MgCl2
A.①②③ B.①③
C.②④ D.①③⑤
[解析] 加入NaOH出现白色沉淀可能是①Mg(OH)2,
②NaHCO3与BaCl2在OH-作用下生成BaCO3;加入H2SO4生成沉淀和气体,则可能是BaSO4,气体为CO2,则肯定有BaCl2;肯定有NaHCO3,故选B。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com