
题目列表(包括答案和解析)
15.在浓硝酸中放入铜片:
(1)开始反应的化学方程式为________________________________________________________________________
________________________________________________________________________,
实验现象为________________________________________________________________________。
(2)若铜有剩余,则反应将要结束时的化学方程式是________________________________________________________________________
________________________________________________________________________。
(3)待反应停止后,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是________________________________________________________________________
________________________________________________________________________。
(4)在标准状况下,若将12.8 g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6 L(不考虑2NO2 N2O4)。则所消耗的硝酸的物质的量是________,所得气体的平均相对分子质量为__________。
N2O4)。则所消耗的硝酸的物质的量是________,所得气体的平均相对分子质量为__________。
[解析] (2)随着反应的进行,硝酸浓度不断减小,故反应后阶段发生的是铜与稀HNO3的反应。
(4)n(NOx)==0.25 mol,故消耗n(HNO3)=2n(Cu)+n(NOx)=2×+0.25 mol=0.65 mol。
设产生NO2的物质的量为x,则NO的物质的量为(0.25 mol-x)。根据得失电子守恒,得下列方程
x·1+(0.25 mol-x)×3=×2
解得:x=0.175 mol。
所以所得气体的摩尔质量为:
=41.2 g·mol-1,
故所得气体的平均相对分子质量为41.2。
[答案] (1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 溶液逐渐变蓝,有红棕色气体逸出
(2)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)加入稀H2SO4后,与原溶液中的NO3-构成强氧化性的条件,又能与过量的Cu反应,反应原理如(2)
(4)0.65 mol 41.2
14.铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同。
(1)某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤。
药品:稀硝酸、稀盐酸、Zn粒、CaCO3固体
步骤:
①检查装置的气密性;
②________________________________________________________________________;
③________________________________________________________________________
______________________________;
④________________________________________________________________________;
⑤______________________________;
⑥用注射器向试管内推入氧气(或空气)。
(2)推入氧气或空气的目的是________________________________________________________________________。
(3)分别将等质量的铜片与等体积均过量的浓硫酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗?________(填“同意”或“不同意”),原因是________________________________________________________________________
________________________________________________________________________;
另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之________________________________________________________________________
________________________________________________________________________(简述实验方案和实验现象)。
[解析] 本题主要考查硝酸的性质(强氧化性)、化学实验等知识的应用及在实验中探索发现问题、解决问题的能力。
[答案] (1)②向试管中加入一定量的CaCO3固体
③向试管中倒入过量的稀HNO3,并迅速盖上带铜丝和导管的橡皮塞
④待反应完全后,将右边导管插入试管内接近液面
⑤将铜丝插入到溶液中
(2)检验生成的NO气体
(3)不同意 铜片质量相同,溶液体积相同,生成的Cu2+浓度相同 加热绿色溶液,有红棕色气体产生,溶液变成蓝色
13.(2010年淄博质检)某化学课外小组欲用固体与液体反应(不需加热),快速简便地制取一满瓶(125 mL)干燥的氧气。


(1)从所提供的仪器(或装置)A至G中,选出所需要的(填序号)________。
(2)选用的试剂为______________________,化学反应方程式为________________________________________________________________________
____________________________。
(3)用上述所选的气体发生装置,除可制取O2、H2、CO2外,请于下表中写出还可用此装置制取的2种其他气体及制取该气体所需的试剂。
|
|
气体 |
所需试剂 |
|
① |
|
|
|
② |
|
|
[解析] 可利用Na2O2和H2O反应制取O2,可用碱石灰或浓H2SO4干燥O2。
[答案] (1)AE(或F)C
(2)Na2O2、H2O、碱石灰(或浓H2SO4) 2Na2O2+2H2O===4NaOH+O2↑(其他答案,合理即可)
(3)
|
|
气体 |
所需试剂 |
|
① |
NH3 |
浓氨水、生石灰 |
|
② |
SO2 |
Na2SO3、浓硫酸 |

12.已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质。若在常温下将气体D通入水中可以发生反应,生成C和E。工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答下列问题:
(1)B分子的电子式为________。
(2)实验室制取A的化学反应方程式为:________________________________________________________________________
________________________________。
(3)E具有不稳定性,因此实验室中保存E的方法是________________________________________________________________________
________________________________________________________________________。
(4)工业上若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式:________________________________________________________________________
__________________________________。当反应中转移的电子为3 mol时,被氧化的A在标准状况下的体积为________L。
[解析] (1)由题意可知:A中Y的价态最低,且可作生产硝酸的原料,故A为NH3;作为单质的B为N2。
(2)实验室制取NH3,通常以NH4Cl(s)和熟石灰混合共热制得。
(3)浓HNO3见光受热易分解,因此在保存时注意避光、阴凉。
(4)Cl2与NH3易发生反应:
 ===6NH4Cl+N2,大量白烟是生成NH4Cl的缘故。每2 mol NH3被氧化转移6 mol电子,故每转移3 mol电子被氧化的NH3在标准状况下的体积为:
===6NH4Cl+N2,大量白烟是生成NH4Cl的缘故。每2 mol NH3被氧化转移6 mol电子,故每转移3 mol电子被氧化的NH3在标准状况下的体积为:
1 mol×22.4 L·mol-1=22.4 L。
[答案] (1)··N⋮⋮N··
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)密封于棕色试剂瓶,并置于阴凉处
(4)8NH3+3Cl2===6NH4Cl+N2 22.4
11.将盛有a mol NO2和b mol NO(标准状况下)混合气体的试管倒立于水槽中,再通入b mol O2,充分反应后试管里剩余气体的成分及物质的量决定于a与b的关系,请填写表格:
|
a与b的关系 |
剩余气体的成分 |
剩余气体物质的量 |
|
若a=b |
|
|
|
若a>b |
|
|
|
若a<b |
O2 |
|
[解析] 把NO2(a mol)转化为NO,则NO总量为 mol,由4NO+3O2+2H2O===4HNO3,需O2量x=。讨论:若a=b,则x=b刚好反应;若a>b,则x>b,NO过量,余n(NO)= mol-b mol= mol;若a<b,则x<b,O2过量,余n(O2)=b mol- mol= mol。
[答案]
|
a与b的关系 |
剩余气体的成分 |
剩余气体物质的量 |
|
若a=b |
无 |
0 |
|
若a>b |
NO |
|
|
若a<b |
O2 |
|
10.(2010年温州质检)下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
[解析] 当X是强酸如盐酸时,若A是硫化钠,则B是硫化氢,C是硫,D是二氧化硫,E是三氧化硫,F是H2SO4;当X是强碱时,若A是铵盐,B是氨气,C是氮气;D是一氧化氮,E是二氧化氮,F是HNO3;B和Cl2的反应可能是:H2S+Cl2===S↓+2HCl或8NH3+3Cl2===N2+6NH4Cl。当X是强酸时,C在常温下只能是固态单质S。
[答案] D
9.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL
C.30 mL D.15 mL
[解析] 由题意可知:HNO3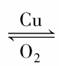 ,由图分析可得:Cu失去的电子数与O2得到的电子数相等。即n(Cu)=2n(O2)=2×=0.15 mol。根据质量守恒及NaOH和Cu(NO3)2的反应可得关系式:n(NaOH)=2n[Cu(NO3)2]=2n(Cu)=0.3 mol,则V(NaOH)==0.06 L=60 mL。
,由图分析可得:Cu失去的电子数与O2得到的电子数相等。即n(Cu)=2n(O2)=2×=0.15 mol。根据质量守恒及NaOH和Cu(NO3)2的反应可得关系式:n(NaOH)=2n[Cu(NO3)2]=2n(Cu)=0.3 mol,则V(NaOH)==0.06 L=60 mL。
[答案] A
8.(2010年启东质检)为了社会可持续发展,化工生产过程应尽量减少对环境的副作用。“绿色化学”是当今社会提出的一个新概念,它要求从经济、环保和技术上设计可行的化学反应,据此,由单质铜制取硝酸铜的下列衍变关系可行且符合“绿色化学”的是( )
A.CuCu(NO3)2
B.CuCuOCu(NO3)2
C.CuCuOCu(OH)2Cu(NO3)2
D.CuCuSO4Cu(NO3)2
[解析] 本题主要考查“绿色化学”知识。绿色化学要求尽可能地利用原料并保证生产过程无污染。A和D中,铜与硝酸或硫酸反应都会有污染物生成,不符合“绿色化学”的思想;C中将CuO再转化为Cu(OH)2,在技术上难以实现,且增加了步骤,不符合“绿色化学”中经济的要求。
[答案] B
7.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述中正确的是( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
[解析] 由影响反应速率的条件可知,浓度越大,反应速率越大,A不正确;由Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O知,等质量的Cu参加反应消耗的浓HNO3多,B正确;显然C选项不正确;由于Cu的质量相等,故反应过程中都生成Cu2+时,二者转移的电子总数相等,D不正确。
[答案] B
6.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NH3、NO2、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
[解析] 因是无色混合气体,证明没有NO2的存在,故A、C错误,又经过系列实验的处理得酸性溶液且通过足量Na2O2后显红棕色,最后通入水中无气体剩余,证明甲气体中无N2,应存在NH3、NO、CO2气体,故B正确。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com